電解質の電気抵抗と電気伝導率
こちらのページでは、電解質の電気抵抗や電気伝導率に関する以下の内容について解説しています。
・電気抵抗と電気伝導率
・電解質の伝導率 -モル伝導度-
・電解質の伝導率 -コールラウシュの法則、イオン独立移動の法則-
というテーマで解説していきます。
電気抵抗と電気伝導率
電気伝導とは一言でいうと「電気の流れやすさ」と表現できます。
電気が流れる、つまり電荷が移動するためには電荷を運ぶもの(キャリア)が必要です。
そして、このキャリアは主に以下のよう分類できます。
①キャリア:電子 → 電子伝導
②キャリア:イオン → イオン伝導
これらキャリアが運ぶ電荷の量が多く、物質中に含まれるキャリアの体積密度が高く、またキャリア自身が
移動しやすいほど電気が流れやすく、つまり電気抵抗が小さくなります。
この電気抵抗を以下の例を用いて解説します。
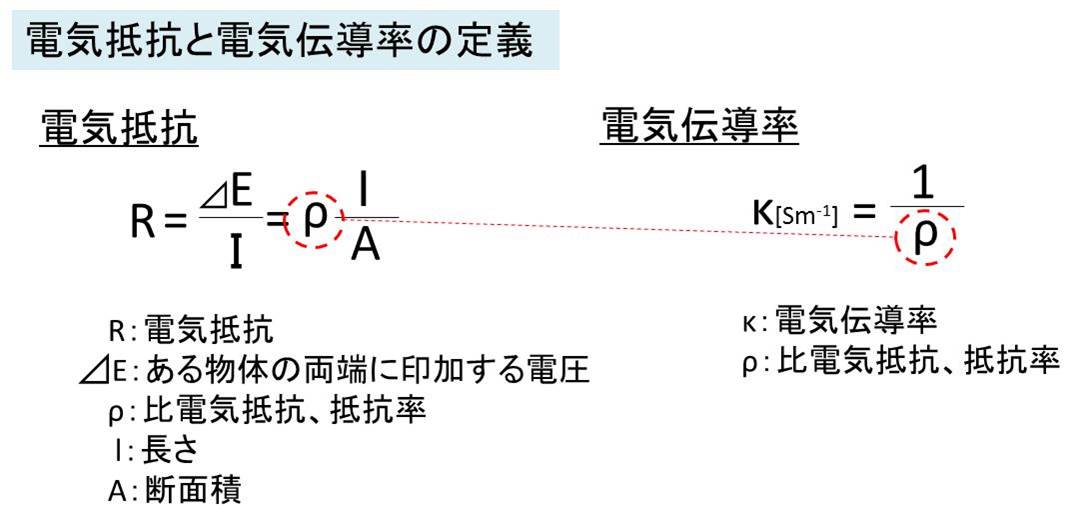
断面積A、長さがlの物体の両端に電圧⊿Eを印加したとします。
すると、オームの法則による電気抵抗R=⊿E/I となります。
さらに、比電気抵抗ρ(別名抵抗率)を用いて表すと、電気抵抗は長さに比例し、断面積に反比例するため、
R=ρl/Aとなります。
この電気抵抗R値が小さいほど、抵抗が小さく電気が流れやすいです。
このρは物質により異なり、この逆数をとったκが電気伝導率に当たります。
電気伝導率の単位は「S/m」というものです。
このSはジーメンスと呼び、Ωの逆数を取ったものです。
なじみが無いかもしれませんので、きちんと理解しましょう。
(細かいことを言うと電気化学の世界ではmでなくcmで記載することが多いです
(後に示す具体的な値もcmで記載しています))。
正極電極に導電助剤として入れる炭素(黒鉛)は金属ほどではないですが、7.3×10^2 /Scm^-1と
高い電子伝導性を示します(正極の電極構造はこちらで解説しています)。
ちなみに金属はキャリアは電子であり、その電子伝導率は10^5~6 /Scm^-1 オーダー程度と非常に高いです。
また、絶縁体では全く電気が流れないのでは?と思った方もいるかもしれないですが、絶縁体は電気伝導率が非常に低い(10^-15 /Scm^-1 オーダー程度)だけであり、高い電圧を印加することで理論的には電流が流れます。
基本的には、電流が流れないようにするためある製品の一部に絶縁体を使用しますが、設計以上に電圧がかかってしまった場合は電気が流れてします場合もあります。
これを上記の現象を絶縁破壊と呼び、限界の抵抗値を絶縁抵抗と呼びます。
関連記事
絶縁抵抗とは?
オームの法則とは?
リチウムイオン電池における電極構造とは?
電解質の伝導率 -モル伝導度-
まず、電解質の定義を下記に示します。
電解質とは、極性溶媒(水や電池に使用されている有機電解液等)に溶かすと電離し、
陽イオン(カチオン)と陰イオン(アニオン)に分かれる物質のことを指します。
リチウムイオン電池では、現在(2017年)のところ、液体の有機系電解質が主に使用されていますが、
今後は安全性が高く、扱いやすい固体電解質などが主流になるかもしれませんね。
また、溶媒を含まずイオンのみから構成される液体をイオン液体、イオン溶融塩と呼び、これらも多く研究されています。
また、イオン伝導性を示す物質のことをイオン伝導体(例えば上述だと溶媒、電解質ともに含んだ有機電解液や水溶液)と呼びます。
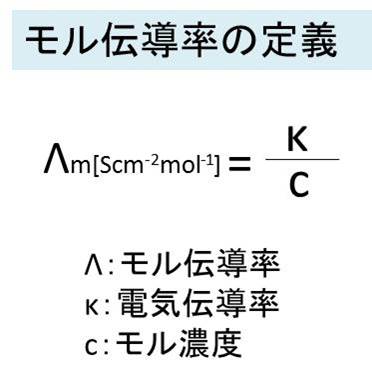
ここでイオン伝導体の単位モル当たりの電気伝導率を表すモル伝導率の定義を下記に示します。
イオン伝導体の電気伝導率κを濃度cで割ることにより算出されます。
電気伝導率は濃度に比例するため、モル伝導率に変換することで、伝導率のポテンシャルと比較できるようになると言えるでしょう。
ただし、このモル伝導率は物質が同じでも濃度により値が変化し、一般的に濃度が高くなるほど、モル伝導率が小さくなる傾向にあります。
イメージとしては、単純にキャリアの濃度が高まったとしても、すべてが効率的に利用されるわけではなく、逆に濃度が高い分、相互作用により、単位当たりの伝導の能力が下がってしまうと考えると良いでしょう(私の意見です)。
関連記事
電解液の材料化学
リチウムイオン電池におけるイオン液体とは?
電解質の伝導率 -コールラウシュの法則、イオン独立移動の法則-
強電解質の場合
モル伝導率と電解質の関係を示すものに、コールラウシュの法則というものがあります。
ただし、これは強電解質と呼ばれる完全に電離するもののみに適用できる法則ですので、
気を付けましょう。
モル伝導率は、極限モル伝導率(濃度0の時のモル伝導率、グラフでいうと切片に当たる)
と定数K×濃度c^1/2の積との和です。
濃度cの1/2乗に比例していくことが重要なポイントです。

また、極限モル伝導率Λm○は各々のカチオンとアニオンの寄与率の和で表すことが出来、
これを表した法則をイオン独立移動の法則と呼びます。

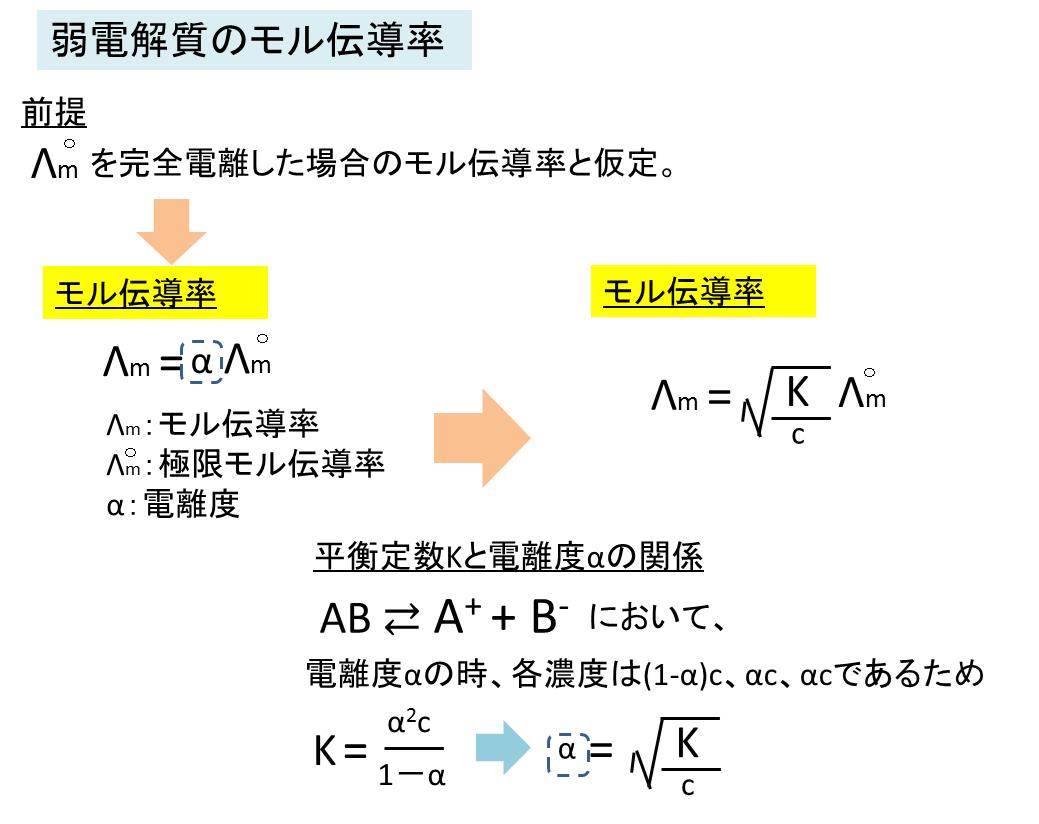
弱電解質の場合
弱電解質の場合は、極限モル伝導率Λm○が電離度100%つまり、α=1の時の値と仮定し、
Λm=α Λm○の関係を満たします。
また、高校化学でも習う平衡定数と電離度の関係式からK=α^2c/(1-α)cの関係からα=(K/c)^1/2を代入すると、
Λm=(K/c)^1/2Λm○
の関係が導かれます。
関連記事
平衡定数とは?
電解液の材料化学
リチウムイオン電池におけるイオン液体とは?
電解質の電気抵抗、電気伝導率 関連ページ
- エネルギー変換
- 化学変化の基礎(エンタルピー、エントロピー、ギブズエネルギー)
- 反応ギブズエネルギーと標準生成ギブズエネルギー
- 化学平衡と化学ポテンシャル、活量、平衡定数○
- 電圧とギブズエネルギーの関係○
- 化学ポテンシャルと電気化学ポテンシャル、ネルンストの式○
- ネルンストの式の導出
- 【演習問題】ネルンストの式を使用する問題演習をしよう!
- 電池反応に関する標準電極電位のまとめ(一覧)
- 標準電極電位とは?電子のエネルギーと電位の関係から解説
- 標準電極電位の表記例と理論電圧(起電力)の算出【電池の起電力の計算】
- 標準電極電位と金属の電子状態○
- 電池内部の電位分布、基準電極に必要なこと○
- 基準電極の種類
- 電気二重層、表面電荷と電気二重層モデル
- 電気化学の測定方法 -三電極法-
- サイクリックボルタンメトリーの原理と測定結果の例
- サイクリックボルタンメトリーにおける解析方法
- LSVの原理と測定結果の例
- クロノアンぺロメトリ―の原理と測定結果の例
- クロノポテンショメトリ―の原理と測定結果の例
- 電荷移動律速と拡散律速(電極反応のプロセス)○
- リチウムイオン電池と等価回路(ランドルス型等価回路)
- リチウムイオン電池と交流インピーダンス法【インピーダンスの分離】
- 【拡散律速時のインピーダンス】ワールブルグインピーダンスとは?限界電流密度とは?【リチウムイオン電池の抵抗成分】
- イオンの移動度とモル伝導率 輸率とその計算方法は?
- イオン強度とは?イオン強度の計算方法は?
- 電子授受平衡と交換電流、交換電流密度○
- Butler-Volmerの式(過電圧と電流の関係式)○
- Tafel式とは?Tafel式の導出とTafelプロット○
- 【演習】アレニウスの式から活性化エネルギーを求める方法
- 活性化エネルギー詳細
- 加速劣化試験と電池部材の耐食性評価
- 腐食とは?腐食の種類と電位-pH図
- めっきとは?めっきの役割と種類
- 自己触媒めっきと自己触媒
- 【演習問題】電流効率とは?電流効率の計算方法【リチウムイオン電池部材のめっき】
- 隙間腐食(すきま腐食)の意味と発生メカニズム
- 電食・ガルバニック腐食・異種金属腐食
- 濃淡電池の原理・仕組み 酸素濃淡電池など
- 浸透探傷試験(レッドチェック)
- ファラデーの法則とは?ファラデー電流と非ファラデー電流とは?
- ド・ブロイの物質波とハイゼンベルグの不確定性原理
- 波動関数と電子の存在確率(粒子性と波動性の結び付け)
- シュレーディンガー方程式とは?波の式からの導出
- 波の式を微分しシュレーディンガー方程式を導出
- 井戸型ポテンシャルの問題とシュレーディンガー方程式の立式と解
- オイラーの公式と導出
- 光と電気化学 基底状態と励起状態 蛍光とりん光 ランベルト-ベールの式
- 光束・光度・輝度の定義と計算方法【演習問題】
- 電磁波の分類 波長とエネルギーの関係式 1eVとは?eV・J・Vの変換方法【計算問題】
- 光と電気化学 励起による酸化還元力の向上
- 溶解度積と沈殿平衡 導出と計算方法【演習問題】
- 再配向エネルギーと活性化エネルギー
- 内圏型と外圏型電子移動の違い
- pHメーター(pHセンサー)の原理・仕組みは?pHメーターとネルンストの式
- ガスセンサー(固体電解質)の原理とは?ネルンストの式との関係は?
- オリゴマーとは?ポリマーとオリゴマーの違いは?数平均分子量と重量平均分子量の求め方【演習問題】
- 面心立方格子、体心立方格子、ミラー指数とは?【リチウムイオン電池の正極材の結晶構造は】
- アタクチックポリマー、イソタクチックポリマー、シンジオタクチックポリマーの違いは?【ポリマーのタクチシチ―】
- おすすめの電気化学の参考書
- 【電流密度】電流密度と電流の関係を計算してみよう【演習問題】
- ギブズの相律とは?F=C-P+2とは?【演習問題】
- 状態関数と経路関数 示量性状態関数と示強性状態関数とは?
- 定容熱容量(Cv)と定圧熱容量(CP)とは?違いは?
- 分子間相互作用
- 理想気体と実在気体の状態方程式(ファンデルワールスの状態方程式) 排除体積とは?排除体積の計算方法
- オクテット則
- 【緩衝作用】酢酸の緩衝溶液のpHを計算してみよう【酢酸の解離平衡時の平衡定数】
- 電子軌道 s軌道・p軌道とは?
- 混合エントロピー 計算と導出方法は?
- 錯体・キレート 錯体平衡の計算問題を解いてみよう【演習問題】
- 「速度論的に安定」と「熱力学的に安定」
- 触媒の仕組みと化学反応
- 分配平衡と分配係数・分配比 導出と計算方法【演習問題】
- 塩橋の役割と入れる理由
- レナードジョーンズポテンシャル 極小値の導出と計算方法【演習問題】
- ルイス酸とルイス塩基の定義 見分け方と違い
- 膜電位の定義と計算方法
- トルートンの規則 トルートンの式
- 化学におけるクラスターとは
- 結晶粒界(粒界)の定義と粒界腐食
- 化学におけるキャラクタリゼーションとは
- 化学におけるバルクとは?バルク水とは
- 電気化学における活性・不活性とは?活性電極と不活性電極の違い
- 1eVは熱エネルギー(温度エネルギー)に換算するとどのくらいの大きさになるのか
- 物質の相図(状態図)と物質の三態の関係 水の状態図の見方 蒸発・凝縮・融解・凝固・昇華・凝結とは? 三重点と臨界点とは?
- プランク定数とエイチ÷2πの定数(エイチバー:ディラック定数)との関係
- 活量係数とは?活量係数の計算問題をといてみよう【活量と活量係数の関係】
- 光触媒である二酸化チタンの原理や用途
- 水素脆性(ぜいせい)、水素脆化の意味と発生の原理は?ベーキング処理とは?
- 波数と波長の変換(換算)の計算問題を解いてみよう
- 波長と速度と周波数の変換(換算)方法 計算問題を解いてみよう
- 波数とエネルギーの変換方法 計算問題を解いてみよう