化学変化の基礎(エンタルピー、エントロピー、ギブズエネルギー)
このページでは、化学変化が自発的に起こる指標であるギブズエネルギーと、ギブズエネルギーを理解する上で大事なエンタルピー、エントロピーについて解説します。
電池の反応を理解する上で、化学変化が自発的に起こる方向を理解することが大事です。
エンタルピー
エンタルピーとは H=U+pV で表される状態量です。
(H:エンタルピー、U:内部エネルギー、p:圧力、V:体積)
力学における位置エネルギーと運動エネルギーの和のようなイメージで捉えると良いでしょう。
また、状態量とは経路や履歴に関係しない物理量のことです。
例えば温度をT→T'に変化させようとする場合(T'>T)、外部から仕事を加えたり、熱を与える等が考えられます。仕事や熱を加える時間であったり、加える割合が何であるにせよ、結果としてT→T'になっていれば良く、この結果に当たる量のことを状態量(もしくは状態関数)と呼んでいます。
(※状態関数についてはこちらで詳しく解説しています)
また、エンタルピーは定圧化における系に出入りする熱エネルギーのことを指します。
電池の反応を考える上では、化学反応におけるエンタルピー変化⊿Hを考えることが重要です。
エンタルピー変化は、様々な化学反応における反応熱の符号を逆にしたものであり、下に記載するギブズエネルギーを構成する項の一つです。
下記にエンタルピー変化を表した反応の例を示します。
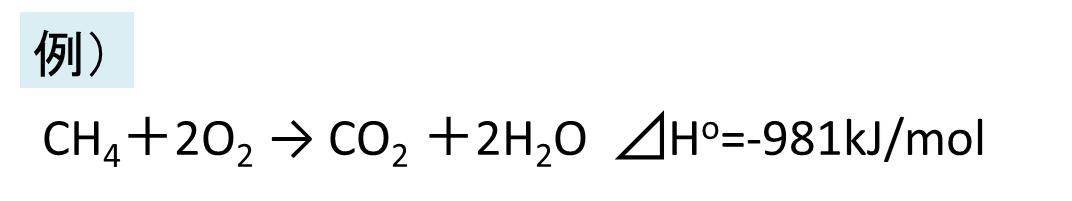
この反応では、標準状態(熱力学では25℃、1atmの状態)で左辺→右辺(生成系)の反応にて981kJ/molの発熱が起こることを表しています(反応式の書き方、各種記号の例はこちらで解説しています)。
左辺のメタンのC-H結合と酸素のO=O結合が切れるときのエネルギー消費と右辺の二酸化炭素のC=O結合や水のO-H結合が生成される際のエネルギー放出との収支で、発熱がおこるか吸熱が起こるか、また発熱量や吸熱量が決まります。
関連記事
エネルギー変換とは?
状態関数とは?
化学ポテンシャルとは?
混合のエントロピーの計算・導出方法
エントロピー
エントロピーとは dS=dQrev/T で表される状態量であり、秩序を表す指標と言えます。
(S:エントロピー、Qrev:可逆過程の熱量、T:温度)
式変形して、T⊿S=⊿Qとしますと、単位がJになり、エネルギーを表します。
またT⊿Sは下のギブズエネルギーを構成する項の一つですので重要であり、特に符号を変えた-T⊿S(⊿Sが正だと自然に進む方向であるため)は秩序を保つためのエネルギーを表します。
孤立した系では、自発的に反応が進む場合エントロピーは増大します(熱力学第2法則)
(何もしないと部屋が散らかっていくイメージでとらえると良いでしょう)。
関連記事
エネルギー変換とは?
状態関数とは?
化学ポテンシャルとは?
混合のエントロピーの計算・導出方法
ギブズエネルギー
ギブズエネルギーとは ⊿G=⊿H-T⊿S で表される状態量です。
(G:ギブズエネルギー、H:エンタルピー、S:エントロピー)
孤立系では⊿Sに着目することで自発変化の方向がわかることを上に解説しましたが、孤立系以外ではギブズエネルギー変化⊿Gに着目すること(もちろん孤立系においても⊿H=0となるため適用できます)で自発変化の方向がわかり、⊿G<0のときに反応が自発的に進みます。
また、上述したように⊿Hは各結合が切れたり、生成されることでのエネルギー収支であり、-T⊿Sは粒子の秩序を保つためのエネルギーでした。
これらを合わせた⊿G=⊿H-T⊿S実際に仕事に使用できるエネルギーと言えます(下図イメージ)。
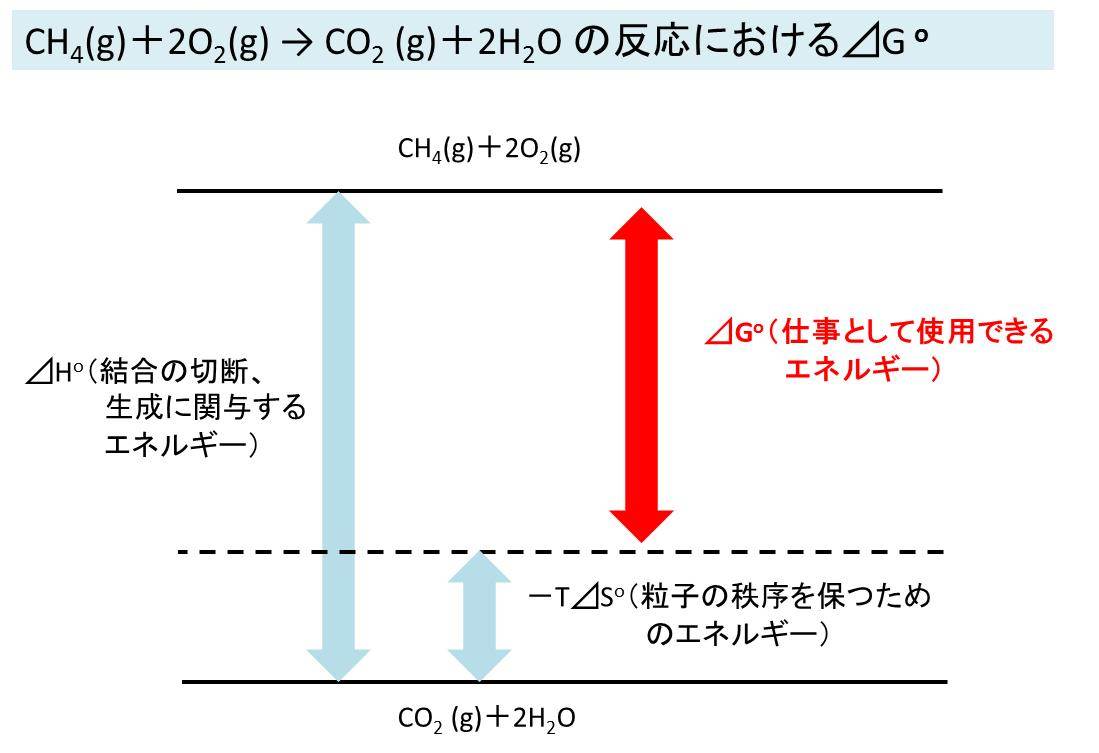
⊿G(自発変化が起こる向き)はエネルギー変換における基礎なのできちんと理解しましょう。
またある反応における⊿Gの値を知りたいときは、通常標準生成ギブズエネルギーという、ある化合物を単体から作った際のギブズエネルギーを算出する必要があります。
関連記事
エネルギー変換とは?
状態関数とは?
化学ポテンシャルとは?
混合のエントロピーの計算・導出方法
化学変化の基礎(エンタルピー、エントロピー、ギブズエネルギー) 関連ページ
- エネルギー変換
- 反応ギブズエネルギーと標準生成ギブズエネルギー
- 化学平衡と化学ポテンシャル、活量、平衡定数○
- 電圧とギブズエネルギーの関係○
- 化学ポテンシャルと電気化学ポテンシャル、ネルンストの式○
- ネルンストの式の導出
- 【演習問題】ネルンストの式を使用する問題演習をしよう!
- 電池反応に関する標準電極電位のまとめ(一覧)
- 標準電極電位とは?電子のエネルギーと電位の関係から解説
- 標準電極電位の表記例と理論電圧(起電力)の算出【電池の起電力の計算】
- 標準電極電位と金属の電子状態○
- 電池内部の電位分布、基準電極に必要なこと○
- 基準電極の種類
- 電気二重層、表面電荷と電気二重層モデル
- 電気化学の測定方法 -三電極法-
- サイクリックボルタンメトリーの原理と測定結果の例
- サイクリックボルタンメトリーにおける解析方法
- LSVの原理と測定結果の例
- クロノアンぺロメトリ―の原理と測定結果の例
- クロノポテンショメトリ―の原理と測定結果の例
- 電荷移動律速と拡散律速(電極反応のプロセス)○
- リチウムイオン電池と等価回路(ランドルス型等価回路)
- リチウムイオン電池と交流インピーダンス法【インピーダンスの分離】
- 【拡散律速時のインピーダンス】ワールブルグインピーダンスとは?限界電流密度とは?【リチウムイオン電池の抵抗成分】
- 電解質の電気抵抗、電気伝導率
- イオンの移動度とモル伝導率 輸率とその計算方法は?
- イオン強度とは?イオン強度の計算方法は?
- 電子授受平衡と交換電流、交換電流密度○
- Butler-Volmerの式(過電圧と電流の関係式)○
- Tafel式とは?Tafel式の導出とTafelプロット○
- 【演習】アレニウスの式から活性化エネルギーを求める方法
- 活性化エネルギー詳細
- 加速劣化試験と電池部材の耐食性評価
- 腐食とは?腐食の種類と電位-pH図
- めっきとは?めっきの役割と種類
- 自己触媒めっきと自己触媒
- 【演習問題】電流効率とは?電流効率の計算方法【リチウムイオン電池部材のめっき】
- 隙間腐食(すきま腐食)の意味と発生メカニズム
- 電食・ガルバニック腐食・異種金属腐食
- 濃淡電池の原理・仕組み 酸素濃淡電池など
- 浸透探傷試験(レッドチェック)
- ファラデーの法則とは?ファラデー電流と非ファラデー電流とは?
- ド・ブロイの物質波とハイゼンベルグの不確定性原理
- 波動関数と電子の存在確率(粒子性と波動性の結び付け)
- シュレーディンガー方程式とは?波の式からの導出
- 波の式を微分しシュレーディンガー方程式を導出
- 井戸型ポテンシャルの問題とシュレーディンガー方程式の立式と解
- オイラーの公式と導出
- 光と電気化学 基底状態と励起状態 蛍光とりん光 ランベルト-ベールの式
- 光束・光度・輝度の定義と計算方法【演習問題】
- 電磁波の分類 波長とエネルギーの関係式 1eVとは?eV・J・Vの変換方法【計算問題】
- 光と電気化学 励起による酸化還元力の向上
- 溶解度積と沈殿平衡 導出と計算方法【演習問題】
- 再配向エネルギーと活性化エネルギー
- 内圏型と外圏型電子移動の違い
- pHメーター(pHセンサー)の原理・仕組みは?pHメーターとネルンストの式
- ガスセンサー(固体電解質)の原理とは?ネルンストの式との関係は?
- オリゴマーとは?ポリマーとオリゴマーの違いは?数平均分子量と重量平均分子量の求め方【演習問題】
- 面心立方格子、体心立方格子、ミラー指数とは?【リチウムイオン電池の正極材の結晶構造は】
- アタクチックポリマー、イソタクチックポリマー、シンジオタクチックポリマーの違いは?【ポリマーのタクチシチ―】
- おすすめの電気化学の参考書
- 【電流密度】電流密度と電流の関係を計算してみよう【演習問題】
- ギブズの相律とは?F=C-P+2とは?【演習問題】
- 状態関数と経路関数 示量性状態関数と示強性状態関数とは?
- 定容熱容量(Cv)と定圧熱容量(CP)とは?違いは?
- 分子間相互作用
- 理想気体と実在気体の状態方程式(ファンデルワールスの状態方程式) 排除体積とは?排除体積の計算方法
- オクテット則
- 【緩衝作用】酢酸の緩衝溶液のpHを計算してみよう【酢酸の解離平衡時の平衡定数】
- 電子軌道 s軌道・p軌道とは?
- 混合エントロピー 計算と導出方法は?
- 錯体・キレート 錯体平衡の計算問題を解いてみよう【演習問題】
- 「速度論的に安定」と「熱力学的に安定」
- 触媒の仕組みと化学反応
- 分配平衡と分配係数・分配比 導出と計算方法【演習問題】
- 塩橋の役割と入れる理由
- レナードジョーンズポテンシャル 極小値の導出と計算方法【演習問題】
- ルイス酸とルイス塩基の定義 見分け方と違い
- 膜電位の定義と計算方法
- トルートンの規則 トルートンの式
- 化学におけるクラスターとは
- 結晶粒界(粒界)の定義と粒界腐食
- 化学におけるキャラクタリゼーションとは
- 化学におけるバルクとは?バルク水とは
- 電気化学における活性・不活性とは?活性電極と不活性電極の違い
- 1eVは熱エネルギー(温度エネルギー)に換算するとどのくらいの大きさになるのか
- 物質の相図(状態図)と物質の三態の関係 水の状態図の見方 蒸発・凝縮・融解・凝固・昇華・凝結とは? 三重点と臨界点とは?
- プランク定数とエイチ÷2πの定数(エイチバー:ディラック定数)との関係
- 活量係数とは?活量係数の計算問題をといてみよう【活量と活量係数の関係】
- 光触媒である二酸化チタンの原理や用途
- 水素脆性(ぜいせい)、水素脆化の意味と発生の原理は?ベーキング処理とは?
- 波数と波長の変換(換算)の計算問題を解いてみよう
- 波長と速度と周波数の変換(換算)方法 計算問題を解いてみよう
- 波数とエネルギーの変換方法 計算問題を解いてみよう