【演習】アレニウスの式から活性化エネルギーを求める方法
このページでは反応速度定数のkを温度、活性化エネルギーなどの関数で表したアレニウスの式について以下のテーマで解説しています。
・アレニウスの式と活性化エネルギーの概要復習
・【演習1】アレニウスの式から活性化エネルギーを求めてみよう(Excel使用)!
・【演習2】アレニウスの式から活性化エネルギーを求めてみよう(Excel使用)!
・【演習3】アレニウス式劣化加速試験での各温度での反応速度定数の予測
・アレニウスの式には気体定数が含まれるが、気体にしか適用されないのか?
・アレニウスプロットが直線にならない理由は?頻度の因子の温度依存性が関係しているのか?
・10℃2倍則とは?アレニウスの式との関係は?
というテーマで解説しています。
アレニウスの式と活性化エネルギーの概要復習
まず、アレニウスの式について解説します。
アレニウスの式とは、化学反応における反応速度定数と温度、活性化エネルギーの関係を表した式です。
アレニウスの式の反応係数Aは頻度因子とも呼ばれ、実験的に求まる定数です(また、化学反応が起こる際分子同士の衝突が起こることで反応が進みます。頻度因子の意味は、反応における分子の衝突の頻度を表しており、衝突理論とも関係があります。)
この頻度因子の単位は速度定数と同じであり、次元によって異なります。例えば、一次反応における頻度因子の単位は【1/s】となり、二次反応における頻度因子の単位は【cm^3 / (mol・s)】となります。ここで、cm^3はLやdm^3などであってもいいです。

このアレニウスの式の両辺対数をとると lnK = lnA -Ea/RT = lnA - m/T となります。
そして、縦軸にlnk、横軸に1/Tをとりプロットしたものをアレニウスプロットと呼び、傾き-mが-Ea/R、切片がlnAとなることから、活性化エネルギーEaや頻度因子Aを求めることが出来ます。
また、活性化エネルギーとはある化学反応を起こすために必要なエネルギーのことであり、特に電子授受反応(電荷移動反応)における活性化エネルギーは、Z(衝突頻度(分子が近づく)×活性化因子(一度の衝突で活性化状態になる確率)×A(非断熱因子(活性化状態で実際に電子移動が起こる確率)により決まります。
当サイトで主に解説しているリチウムイオン電池では、この電子授受反応(電荷移動反応)により充電、放電反応が進むため、その解析にもアレニウスプロットや活性化エネルギー(や再配向エネルギー)の議論が出てきます。
また、電気化学で重要な過電圧と電流の関係式であるバトラー・フォルマー式やターフェル式にもこのアレニウスの式の考え方、アレニウスの式を含んだ項が出てきます。
それでは、具体例を用いてアレニウスの式から活性化エネルギーを求める方法について下で解説します。
アレニウスのプロットを用いて見積もる活性化エネルギーのことを「見かけの活性化エネルギー」と呼ぶ場合があります。
(ちなみに当サイトのメインテーマであるリチウムイオン電池の寿命予測などにもこのアレニウスの式の考え方が用いられているケースもあります)
関連記事
活性化エネルギ-の詳細反応
電子授受反応(電荷移動反応)とは? 電極反応のプロセスも解説
充電、放電方法の種類
活性化エネルギーと再配向エネルギー
バトラー・フォルマー式
ターフェル式
【アレニウスの式の問題演習】リチウムイオン電池の寿命予測(ルート則)
【演習1】アレニウスの式から活性化エネルギーを求めてみよう(Excel使用)!
ある化学反応における反応速度定数が25℃では1.52×10^-3 mol/(L・s)であり、60℃では1.21×10^-2 mol/(L・s)である場合の活性化エネルギーEaを求めてみましょう!
解析の場合はアレニウスプロットを用います。
Excelを用いてグラフを作成していきます(Excelが使用できない場合は手計算で行ってみましょう)。
温度の単位を℃でなく、Kに変換することに注意して、問題におけるlnKと1/Tの値を計算します。
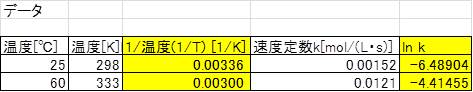
計算結果をもとに、縦軸lnK、横軸1/Tでプロットしましょう。アレニウスの式における傾きの単位やそこから求められる各数値の単位はとても重要ですので、きちんと理解しておきましょう。
すると以下のようなグラフが作成でき、近似曲線を追加すると傾きと切片の値がわかります。

ここで、傾き-5881.7=-Ea/Rにあたるため、Ea=5881.7×R≒48.9kJ/molと算出できるのです。
(R=8.314J/(mol・K)を使用)
関連記事
活性化エネルギ-の詳細反応
バトラー・フォルマー式
ターフェル式
【アレニウスの式の問題演習】リチウムイオン電池の寿命予測(ルート則)
【演習2】アレニウスの式から活性化エネルギーを求めてみよう(Excel使用)!
次に、反応速度定数の詳細がわからず、各温度と反応速度定数の大きさの比が記載されている問題の場合について解説します。
ある化学反応における反応速度定数が25℃と60℃では2倍の差がある場合の活性化エネルギーEaを求めてみましょう。
まず、おおよその式変形のイメージをしてみましょう。
lnK(60℃)=lnA - Ea/R×333・・・①
lnK(25℃)=lnA - Ea/R×298・・・②
ここで①-②をすると
lnK(60℃)-lnK(25℃)= -Ea/R(1/333-1/298) = ln(K(60℃)/K(25℃) = ln2 と変形されていきます。
(もちろんこのまま手計算で解いても良いでしょう)。
Excelを用いて行う場合、結果的にK(60℃)とK(25℃)の比が傾き、つまり活性化エネルギー算出のための項になりますので、この比は2で固定されているため、速度kの比が2となる代替値を使用しましょう。
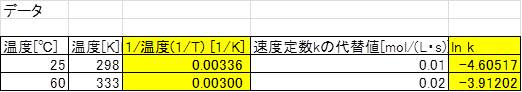
そして演習1同様に、グラフを作成します。
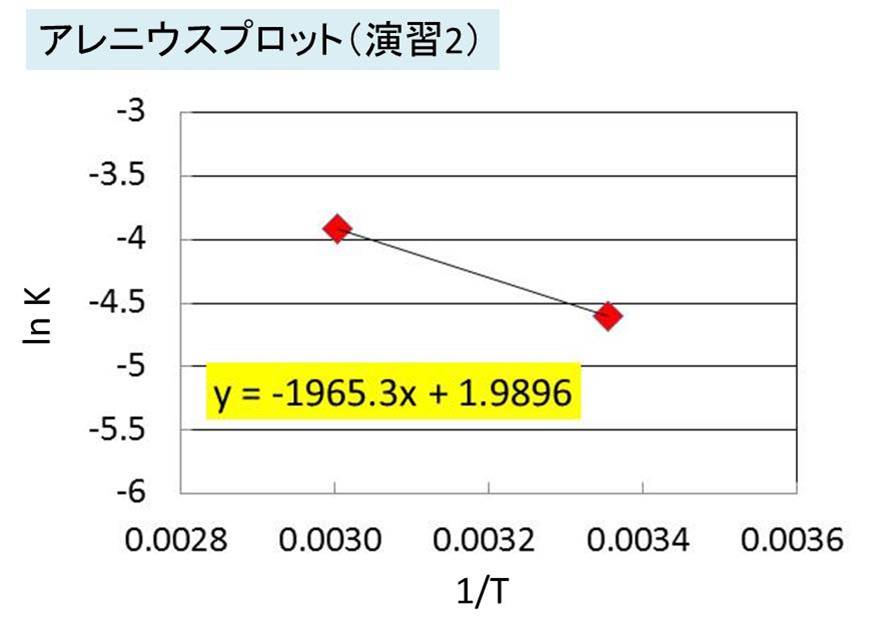
ここで、傾き-1965.3=-Ea/Rにあたるため、Ea=1965.3×R≒16.3kJ/molと算出できます。
(R=8.314J/(mol・K)を使用)
反応速度定数の代替値を例えば25℃で0.02、60℃で0.04と入力した場合でも傾きは変化しないことも確認してみましょう。
こちらにおいても、アレニウス式の傾きから求めた数値の単位が間違がっていないか、確認しましょう。
関連記事
活性化エネルギ-の詳細反応
バトラー・フォルマー式
ターフェル式
【アレニウスの式の問題演習】リチウムイオン電池の寿命予測(ルート則)
【演習3】アレニウス式劣化加速試験での各温度での反応速度定数の予測
上述の演習のようにいくつかの温度における反応速度定数がわかっていると、アレニウスプロットにより他の温度における反応速度定数を予想することができます。
この考え方を元に、劣化予測式(寿命予測式)にこのアレニウスプロットが利用されています。
ある製品の劣化の原因が特定の化学反応であるとわかっている場合、このアレニウスの式を用いてある製品の寿命予測ができます。
また、このような劣化形態をアレニウス式劣化とも呼び、通常は平均25℃付近で使用された場合の寿命を予測するために、より短期間で予測できるよう60℃などの高い温度で加速させて劣化させる試験を行います。
この加速劣化試験をアレニウス式の加速劣化試験と呼ぶこともあります。
例えば、リチウムイオン電池における容量劣化予測であったり(劣化予測式(ルート則))、接着剤の強度劣化予測や材料の特定の物性値劣化の予測などにも使用されています。
こちらのて別途、リチウムイオン電池における容量劣化のデータをもとにその予測を行う方法について解説しいますので、参考にしてみてくださいね。
関連記事
活性化エネルギ-の詳細反応
バトラー・フォルマー式
ターフェル式
【アレニウスの式の問題演習】リチウムイオン電池の寿命予測(ルート則)
アレニウスの式には気体定数が含まれるが、気体にしか適用されないのか?
アレニウスの式において気体定数Rが含まれていますが、気体にしか適用できないのでしょうか?
実は気体の反応だけでなく、液体であっても化学反応であればアレニウスの式に従います。
単純に名前として気体定数Rと名付けられているだけです。アレニウスの式は気相反応だけでなく、液相反応にも使用されることを覚えておきましょう。

関連記事
活性化エネルギ-の詳細反応
バトラー・フォルマー式
ターフェル式
【アレニウスの式の問題演習】リチウムイオン電池の寿命予測(ルート則)
アレニウスプロットが直線にならない理由は?頻度の因子の温度依存性が関係しているのか?
実は、アレニウスプロットが直線にならない理由は、頻度因子の温度依存性が影響していることが多いです。
アレニウスプロットでは、基本的に頻度因子が一定と仮定して、プロットを行いますが、頻度因子の温度依存性が強い場合に直線にならずに低温側では直線よりも、上側にずれ、下に凸な形状になります。
他にも、アレニウスプロットが直線にならない理由は副反応がおこることなどいくつかありますが、あまりにも直線から外れている場合などは、寿命予測や活性化エネルギーの見積もりに使用するべきではありません。
10℃2倍則とは?アレニウスの式との関係は?
アレニウス型の材料の寿命予測の考え方として、10℃2倍則(10℃半減則)と呼ばれるものがあります。
10℃2倍則とは(10℃半減則)とは、寿命の温度依存性の関係を表した経験則であり、「温度が10℃上がると寿命が半分になる(半減する)」「温度が10℃下がると寿命が2倍になる」という法則です。

基本的には、ある実測値をもとにその±10℃の寿命が予測できます。
例えば、ある材料の物性が初期値から特定の値まで劣化するのに、要する時間が30℃で100hであるとします。すると、40℃では50hで同等の劣化が起こり、逆に20℃では200hで同等の劣化がおこるといった具合です。
ただ、先にものべたアレニウスの式でこの10℃2倍則を考えても、ズレが生じます。これは、10℃2倍則が経験則であり、理論的で単純な化学反応のみが起こる場合が少ないことを意味します。
念のため、アレニウスの式を元に10℃ずれた際の劣化挙動を考えていきましょう。
両辺対数をとったアレニウスプロットでは、ln t(基準) = A + Ea/RT 、ln t(+10℃) = A + Ea/R(T+10) という式が立てられます(tは一定まで劣化する時間)。
ここで、先の式から後の式をひくと、 ln (t基準 / t(+10℃)) = Ea / R ( (1/T) - 1/(T+10) ) となります。
左辺が劣化速度をあらわしていますが、右辺の温度Tが変化すると劣化速度が変化しますよね。よって、基準の温度Tが変化すると左辺が変化してしまうために、アレニウスの式だけでは10℃2倍則は成り立ちません。
【演習】アレニウスの式から活性化エネルギーを求める方法 関連ページ
- エネルギー変換
- 化学変化の基礎(エンタルピー、エントロピー、ギブズエネルギー)
- 反応ギブズエネルギーと標準生成ギブズエネルギー
- 化学平衡と化学ポテンシャル、活量、平衡定数○
- 電圧とギブズエネルギーの関係○
- 化学ポテンシャルと電気化学ポテンシャル、ネルンストの式○
- ネルンストの式の導出
- 【演習問題】ネルンストの式を使用する問題演習をしよう!
- 電池反応に関する標準電極電位のまとめ(一覧)
- 標準電極電位とは?電子のエネルギーと電位の関係から解説
- 標準電極電位の表記例と理論電圧(起電力)の算出【電池の起電力の計算】
- 標準電極電位と金属の電子状態○
- 電池内部の電位分布、基準電極に必要なこと○
- 基準電極の種類
- 電気二重層、表面電荷と電気二重層モデル
- 電気化学の測定方法 -三電極法-
- サイクリックボルタンメトリーの原理と測定結果の例
- サイクリックボルタンメトリーにおける解析方法
- LSVの原理と測定結果の例
- クロノアンぺロメトリ―の原理と測定結果の例
- クロノポテンショメトリ―の原理と測定結果の例
- 電荷移動律速と拡散律速(電極反応のプロセス)○
- リチウムイオン電池と等価回路(ランドルス型等価回路)
- リチウムイオン電池と交流インピーダンス法【インピーダンスの分離】
- 【拡散律速時のインピーダンス】ワールブルグインピーダンスとは?限界電流密度とは?【リチウムイオン電池の抵抗成分】
- 電解質の電気抵抗、電気伝導率
- イオンの移動度とモル伝導率 輸率とその計算方法は?
- イオン強度とは?イオン強度の計算方法は?
- 電子授受平衡と交換電流、交換電流密度○
- Butler-Volmerの式(過電圧と電流の関係式)○
- Tafel式とは?Tafel式の導出とTafelプロット○
- 活性化エネルギー詳細
- 加速劣化試験と電池部材の耐食性評価
- 腐食とは?腐食の種類と電位-pH図
- めっきとは?めっきの役割と種類
- 自己触媒めっきと自己触媒
- 【演習問題】電流効率とは?電流効率の計算方法【リチウムイオン電池部材のめっき】
- 隙間腐食(すきま腐食)の意味と発生メカニズム
- 電食・ガルバニック腐食・異種金属腐食
- 濃淡電池の原理・仕組み 酸素濃淡電池など
- 浸透探傷試験(レッドチェック)
- ファラデーの法則とは?ファラデー電流と非ファラデー電流とは?
- ド・ブロイの物質波とハイゼンベルグの不確定性原理
- 波動関数と電子の存在確率(粒子性と波動性の結び付け)
- シュレーディンガー方程式とは?波の式からの導出
- 波の式を微分しシュレーディンガー方程式を導出
- 井戸型ポテンシャルの問題とシュレーディンガー方程式の立式と解
- オイラーの公式と導出
- 光と電気化学 基底状態と励起状態 蛍光とりん光 ランベルト-ベールの式
- 光束・光度・輝度の定義と計算方法【演習問題】
- 電磁波の分類 波長とエネルギーの関係式 1eVとは?eV・J・Vの変換方法【計算問題】
- 光と電気化学 励起による酸化還元力の向上
- 溶解度積と沈殿平衡 導出と計算方法【演習問題】
- 再配向エネルギーと活性化エネルギー
- 内圏型と外圏型電子移動の違い
- pHメーター(pHセンサー)の原理・仕組みは?pHメーターとネルンストの式
- ガスセンサー(固体電解質)の原理とは?ネルンストの式との関係は?
- オリゴマーとは?ポリマーとオリゴマーの違いは?数平均分子量と重量平均分子量の求め方【演習問題】
- 面心立方格子、体心立方格子、ミラー指数とは?【リチウムイオン電池の正極材の結晶構造は】
- アタクチックポリマー、イソタクチックポリマー、シンジオタクチックポリマーの違いは?【ポリマーのタクチシチ―】
- おすすめの電気化学の参考書
- 【電流密度】電流密度と電流の関係を計算してみよう【演習問題】
- ギブズの相律とは?F=C-P+2とは?【演習問題】
- 状態関数と経路関数 示量性状態関数と示強性状態関数とは?
- 定容熱容量(Cv)と定圧熱容量(CP)とは?違いは?
- 分子間相互作用
- 理想気体と実在気体の状態方程式(ファンデルワールスの状態方程式) 排除体積とは?排除体積の計算方法
- オクテット則
- 【緩衝作用】酢酸の緩衝溶液のpHを計算してみよう【酢酸の解離平衡時の平衡定数】
- 電子軌道 s軌道・p軌道とは?
- 混合エントロピー 計算と導出方法は?
- 錯体・キレート 錯体平衡の計算問題を解いてみよう【演習問題】
- 「速度論的に安定」と「熱力学的に安定」
- 触媒の仕組みと化学反応
- 分配平衡と分配係数・分配比 導出と計算方法【演習問題】
- 塩橋の役割と入れる理由
- レナードジョーンズポテンシャル 極小値の導出と計算方法【演習問題】
- ルイス酸とルイス塩基の定義 見分け方と違い
- 膜電位の定義と計算方法
- トルートンの規則 トルートンの式
- 化学におけるクラスターとは
- 結晶粒界(粒界)の定義と粒界腐食
- 化学におけるキャラクタリゼーションとは
- 化学におけるバルクとは?バルク水とは
- 電気化学における活性・不活性とは?活性電極と不活性電極の違い
- 1eVは熱エネルギー(温度エネルギー)に換算するとどのくらいの大きさになるのか
- 物質の相図(状態図)と物質の三態の関係 水の状態図の見方 蒸発・凝縮・融解・凝固・昇華・凝結とは? 三重点と臨界点とは?
- プランク定数とエイチ÷2πの定数(エイチバー:ディラック定数)との関係
- 活量係数とは?活量係数の計算問題をといてみよう【活量と活量係数の関係】
- 光触媒である二酸化チタンの原理や用途
- 水素脆性(ぜいせい)、水素脆化の意味と発生の原理は?ベーキング処理とは?
- 波数と波長の変換(換算)の計算問題を解いてみよう
- 波長と速度と周波数の変換(換算)方法 計算問題を解いてみよう
- 波数とエネルギーの変換方法 計算問題を解いてみよう