単蒸留とは?レイリーの式の導出と単蒸留の図積分を用いた計算問題【演習問題】
当サイトのメインテーマであるリチウムイオン電池は高電圧、高容量、高エネルギー密度、長寿命などのメリットがあるためスマホバッテリーや電気自動車搭載電池、家庭用蓄電池などの採用されています。
ただ近年ではスマホなどのリチウムイオン電池の発火事故が急増しており、リチウムイオン電池の安全性(危険性)が認識されるようになり、この安全性の向上がリチウムイオン電池普及のための課題の一つであるといえます。
IOT化が今後進むにつれ、リチウムイオン電池の重要性がより増してくるため、リチウムイオン電池に関する知識を増やすとより快適な生活が遅れるでしょう。
リチウムイオン電池だけでなく、製造業において化学工学の知識は不可欠です。例えば、リチウムイオン電池の製造工程としては、電極スラリーを混練する際の撹拌する力や与えるエネルギーの設計、電極スラリーを混練したあとの電極基材へ塗布した後のコーターでの乾燥条件の設計などに化学工学の知識が必要になる場合があります。
ここでは、化学工学における基礎である蒸留の中でも「単蒸留」について解説していきます。
単蒸留とは?
単蒸留(Simple Distilaation)とは、最もシンプルな蒸留方法です。学生実験などでも経験したことがある手法といえます。
単蒸留では、ある液体原料中の低沸点成分の濃度を少し高くしたい場合や実験レベルの少量の液体を蒸留にかけたい場合に使用します。つまり、産業的な精度が必要な蒸留ではなく、実験レベルの蒸留というイメージです。
単蒸留の原理(求め方)を以下で解説していきます。基本的には物質収支と低沸点成分の収支を考えることがポイントです。
単蒸留の原理(求め方)
蒸留したい液体の液量L1とし、この中の低沸点成分をx1とします。
蒸留後の液体の液量をL2とし、この中の低沸点成分をx2とします。
留出後の液量をDとし、この中の低沸点成分をxdとします。
そして、液量の収支(物質収支)と低沸点成分の収支を考え、連立方程式を解きます。
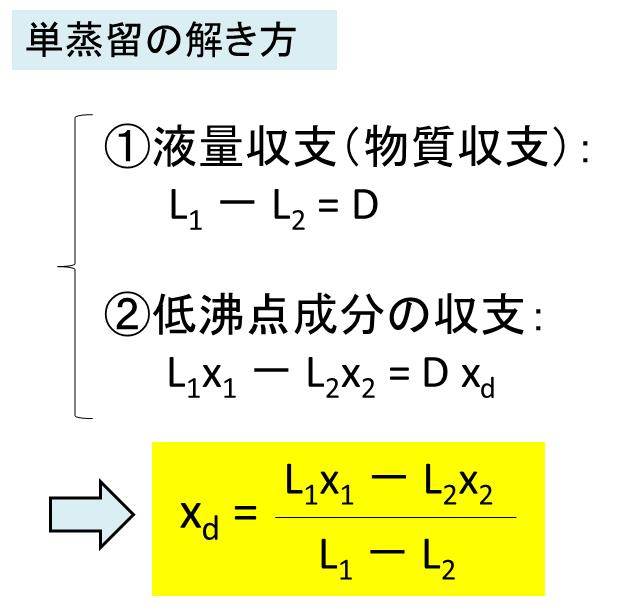
①液量収支 L1 - L2 = D
②低沸点成分の収支 L1x1 - L2x2 = Dxd
①、②の連立方程式を解きますと、Xd = (L1x1 - L2x2) / (L1 - L2) となり、留出液の情報を得ることができます。
ただ、この場合は、各種液量や組成がわかっていないと計算できないため、以下のレイリー(Rayleigh)の式から図積分を用いて算出する求め方もあります。
関連記事
リチウムイオン電池の発火事故のメカニズム
リチウムイオン電池の特徴と構成、反応
図積分とは?
レイノルズ数とは?導出過程は?
フラッシュ蒸留とは?
単蒸留とレイリー(Rayleigh)の式 レイリーの式の導出
次に、レイリーの式と呼ばれる、気液平衡のデータから図積分を用いて留出量や留出組成を計算する方法について考えていきましょう。
もとの液量を前例と同様にLとし、低沸点成分の液組成をx、蒸気組成をyとし、xとyは気液平衡状態にあるとします。
気液平衡状態から、元の液量がdL分微小変化したとすると、液組成もこれに伴うdx変化、蒸気組成もdy変化します。
Lx = (L - dL) (x - dx) + (y-dy) dL という等式が成り立ちます。微小量同士の積の項は無視するとしますと、以下のように変形できます。
Lx = Lx - Ldx + (y-x) dL となり、 dL / L = dx / (y-x) となります。
境界条件として、液量L=L1(初期)とし、組成x =x1としまして上式の両辺を積分していきましょう。
すると ln (L1 / L) = ∫ dx / (y-x) (区間はxからx1)という式が成り立ち、この式がレイリー(Rayleigh)の式であり、上が導出過程です。

このレイリー(Rayleigh)の式は例題によって計算するとより理解が深まるために、以下の演習問題を解いてみましょう。
関連記事
リチウムイオン電池の発火事故のメカニズム
リチウムイオン電池の特徴と構成、反応
図積分とは?
レイノルズ数とは?導出過程は?
フラッシュ蒸留とは?
単蒸留とレイリーの式の例題(演習問題)【Excelを用いて図積分してみよう】
それでは、レイリーの式を用いた演習問題を解いてみましょう。
例題
あるベンゼンの組成50mol%-トルエン組成50mol% の液体200gを単蒸留したとき、ベンゼンの残液中の組成は30mol%であったとします。この場合の留出量と留出液中のベンゼンの組成xdを計算していきましょう。
解答
ln (L1 / L) = ∫ dx / (y-x) (区間はxからx1)というレイリーの式において、初期の液体のmol数を考えていきます。

ます、混合溶液の平均の分子量を計算する必要があり、ベンゼンの分子量78とトルエンの分子量92に各々の組成をかけた和が平均分子量であるといえます。
78×0.5 + 92×0.5 = 85 g/molとなります。

つまり、混合溶液200gは 200 / 85 = 2.35mol = L1 となります。
次に右辺のインテグラルの項を計算したいのですが、直接の計算はできないために図積分を行います。
図積分とは、複雑な曲線を計算しやすい図形に細かく近似してその図形として積分することといえます。
右辺の曲線は以下の図のように複雑であるために、台形近似をして解いていきましょう(ただ気液平衡のデータがそろっていないと図積分はできません)。
ここで、ベンゼンの液組成xの組成が0.5、0.4、0.3の時は、1/(y-x)の値は各々4.67、4.44、4.61です。
これを台形近似して図積分しますと、
(4.67 + 4.44) × 0.1 × 1/2 + (4.44 + 4.61) × 0.1 × 1/2 = 0.908と台形の面積が計算できます。
ln (L1 / L) = ∫ dx / (y-x) (区間はxからx1)のレイリーの式の右辺が0.908であることを意味しており、
ln (L1 / L) = 0.908となります。
よって e^0.908 = L1 / L = 2.48となります。
上でL1が2.35molと計算していたため、 L = 2.35 / 2.48 =0.95 mol となります。
ここで、残液では残りの組成も変化しているため平均分子量も変化し、計算しなおすと、 0.3 × 78 + 0.7× 92 = 87.8となります。
よって L = 0.95 × 87.8 = 83.4gとなります。
つまり留出量Dは 200 - 83.4 = 116.6 gとなります。
最後にxd = (2.35 × 0.5 - 0.95 × 0.3 ) / (2.35 - 0.95 ) = 0.636となり、63.6mol%が留出液の組成であるといえます。
関連記事
リチウムイオン電池の発火事故のメカニズム
リチウムイオン電池の特徴と構成、反応
図積分とは?
レイノルズ数とは?導出過程は?
フラッシュ蒸留とは?
単蒸留とは?レイリーの式の導出と単蒸留の図積分を用いた計算問題【演習問題】 関連ページ
- 熱の伝わり方(伝熱の仕方)の種類
- フーリエの法則と熱伝導(伝導伝熱) 平板・円筒・球での熱伝導度(熱伝導率)の計算方法
- 多層平板における熱伝導(伝導伝熱)と伝熱抵抗 熱伝導度の合成
- ニュートン冷却の法則や総括伝熱係数(熱貫流率・熱通過率)とは?【対流伝熱】
- ニュートン粘性の法則の導出と計算方法 ニュートン流体と非ニュートン流体とは?【粘性係数(粘性率)と速度勾配】
- 放射伝熱(輻射伝熱)とは?プランクの法則・ウィーンの変位則・ステファンボルツマンの法則とは?
- 熱交換器の計算問題を解いてみよう 対数平均温度差(LMTD)とは?【演習問題】
- 比熱の測定方法(簡易版)
- 熱伝導率の測定・計算方法(定常法と非定常法)(簡易版)
- 熱拡散率(温度拡散率)と熱伝導率の変換・計算方法【演習問題】
- 反応速度と定常状態近似法、ミカエリス・メンテン式
- ラウールの法則とは?計算方法と導出 相対揮発度:比揮発度とは?【演習問題】
- 蒸気圧と蒸留 クラウジウス-クラペイロン式とアントワン式
- 流速と流量の計算・変換方法 質量流量と体積流量の違いは?【演習問題】
- 流束と流束密度の違いは? 流束と流束密度の計算問題を解いてみよう【演習問題】
- 流速と流束(フラックス)の違いは? 流束の種類
- レイノルズ数、ファニングの式とは?導出方法と計算方法【粘性力と慣性力の比】
- フラッシュ蒸留と単蒸留とフラッシュ蒸留の違いは?【演習問題】
- 連続蒸留とは?蒸留塔の設計における理論段数・最小還流比とは?【演習問題】
- 蒸留塔における理論段数の算出方法(McCabe-Thiele法による作図)は?理論段数・最小還流比とは?【演習問題】
- ベルヌーイの定理とは?ベルヌーイの定理の問題を解いてみよう【演習問題】
- 反応器(CSTRとPFR)の必要体積の比較の問題【反応工学の問題】
- 逐次反応 複合反応の導出と計算【反応工学】
- 並列反応 複合反応の導出と計算【反応工学】
- 転化率・反応率・選択率・収率 導出と計算方法は?【反応工学】
- 平均滞留時間 導出と計算方法【反応工学】
- 反応次数の計算方法 0次・1次・2次反応【反応工学】
- 粒子の沈降とは?ストークスの法則(式)と終末速度の計算方法【演習問題】
- 含水率とは?湿量基準含水率と乾量基準含水率の違いは?
- 参考文献
- ヌッセルト数(ヌセルト数)・グラスホフ数・プラントル数
- レイリー数(レーレー数)とは?
- U字管マノメーターの原理と計算方法
- 層流・乱流・遷移領域とは?層流と乱流の違い
- 熱伝導率と熱伝達率の違い【熱伝導度や熱伝達係数との違い】
- フィックの法則の導出と計算【拡散係数と濃度勾配】
- 熱抵抗を熱伝導率から計算する方法【熱抵抗と熱伝導率の違い】
- 【ハ-ゲンポアズイユの定理】円管における層流の速度分布を計算する方法
- 質量保存則と一次元流れにおける連続の式 計算問題を解いてみよう【圧縮性流体と非圧縮性流体】
- 静圧と動圧の違い【位置エネルギーと運動エネルギー】
- ゲージ圧力と絶対圧力の違いは?変換(換算)の計算問題を解いてみよう【正圧と負圧の違いは?】
- 熱流束・熱フラックスを熱量、伝熱量、断面積から計算する方法【熱流束の求め方】