電池とは何か?ボルタ電池の構成と反応
こちらのページでは
・電池とは何か?
・ボルタ電池の構成
・ボルタ電池の反応
・ボルタ電池の起電力と分極
・分極を防ぐ方法とダニエル電池
について解説しています(高校化学のカテゴリーとして分類しています)。
※高校化学のカテゴリーページはこちらです。
電池とは何か?
みなさんが生活されている中で、様々な種類の電池を見かけると思います。
今のように性能が高く、値段も安い電池になるまでに、色々な種類の電池が開発、改良されています。
長い電池の歴史の中でも、ボルタ電池は初期の頃に開発された電池であり、根本の原理は現在と同じです。
ここで、まず電池とは何かを考えましょう。
電池とは、化学反応の一つである酸化還元反応を利用し、外部の回路を通すことで、
化学エネルギーを電気エネルギーに変換する装置と言えます。
この前提を元に、ボルタ電池の原理について下で解説します。
ボルタ電池の構成
ボルタ電池は以下のように構成されます。
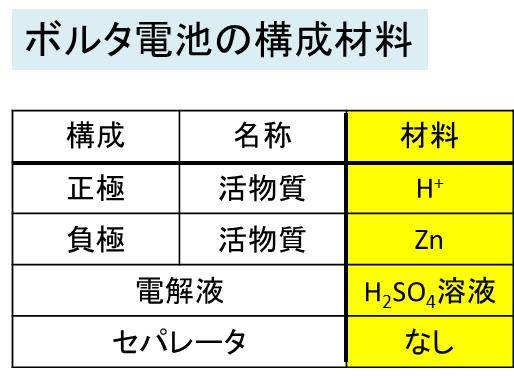
正極に銅(Cu)を使用、負極に亜鉛(Zn)を使用し、共通の電解液として濃硫酸(H2SO4)を使用されたもので構成されます。
ここで、正極、負極において、直接反応に関与するものを活物質と呼び、正極活物質は銅ではなく水素イオンです。
つまり銅は反応せず電解液中の水素イオンが反応します
(ダニエル電池では電解液中の銅イオンが反応することが異なります)。
そして負極活物質は電極と同じ
まとめますと以下の通りになります。きちんと理解しておきましょう。
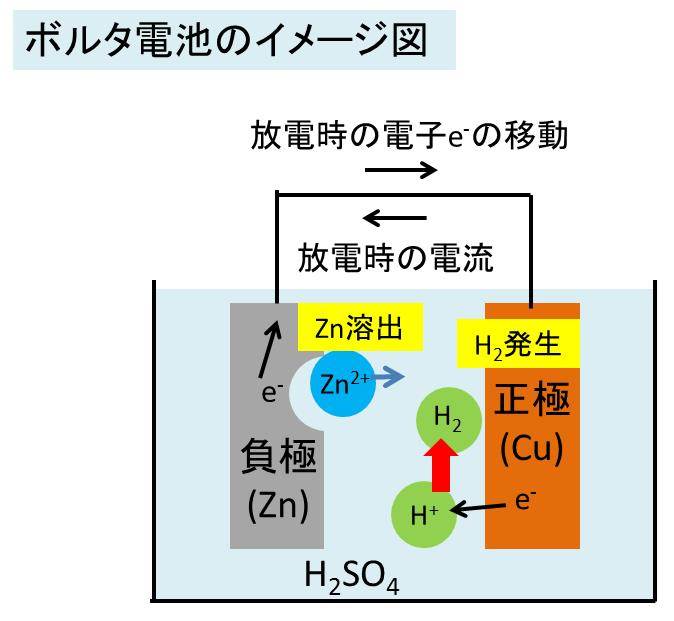
下に構成時のイメージ図を示します。
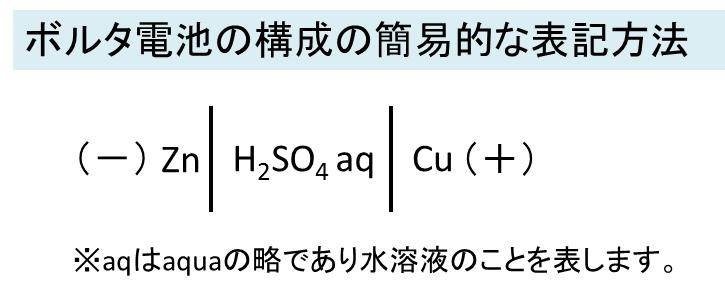
また、上図を下記のよう簡易的に表記することもありますので、覚えておきましょう。
ここでは、構成する電極などの材料を記載することを理解しておきましょう。
ボルタ電池の反応
ボルタ電池では、正極と負極を導線などの導体(外部回路)で上図のようにつなぐことで反応が開始します。
イオン化傾向により、Znの方が水素より溶けやすい(イオン化しやすい)ため、負極ではZnが溶出、正極では水素イオンが反応し水素が発生する反応具体的な反応式は以下の通りです。

ボルタ電池の起電力と分極
ボルタ電池から取り出せる電圧(各電極の電位差のことで理論起電力と呼びます)は1.1V程度です。
ただし、豆電球などの外部回路をつなぎ反応が進むと、分極と呼ばれる現象により起電力が大きく低下します。
簡単に説明しますと正極で発生した水素が反応の邪魔をするということです。
分極を防ぐ方法とダニエル電池
分極の発生原因は正極の水素発生によるということを上で解説しました。
では、水素発生を防ぐためには何をすればよいでしょうか?
答えは、水素イオンの代わりに反応しやすい材料を添加するということです。
つまり、酸化剤、自身は還元されやすいものを添加すればよく、過酸化水素や、ニクロム酸カリウムを添加することで分極を防ぐことが出来ます。
ただし、酸化剤を添加する手間を省くためにボルタ電池の構成自体を変化させ、改良したものをダニエル電池と呼び、ダニエル電池についてはこちらで解説しています。
※大学課程で学ぶ電気化学における分極についてはこちらで解説しています。
※大学課程で学ぶ電気化学において起電力の算出方法を学びます。こちらで解説していますので、興味ある方は参考にしてみてください。
※高校化学ではイオン化傾向として特定の元素のみを羅列していますが、実際はすべての元素でこのイオンになりやすさが存在します。これは大学課程の電気化学で学べ、こちらで解説しています。
電池とは?ボルタ電池の構成と反応 関連ページ
- イオンとはそもそも何のこと?その1 イオン発見の歴史と原子の構造と原子番号、質量数
- 酸化とは?還元とは?酸化還元の定義その1、その2
- 酸化還元の定義その3とまとめ
- ダニエル電池の構成・仕組み・反応式は?正極・負極の反応は?素焼き板の役割は?
- イオン化傾向とは?
- 【手計算・Excel】pHとは?計算方法は?
- 同位体の存在比とは?計算問題を解いてみよう【銅や塩素の質量】
- 分子量の求め方 アンモニア・メタン・尿素などの分子量を計算してみよう【演習問題】
- 原子量・分子量・式量の違いは?
- アレニウス・ブレンステッド・ルイスの酸・塩基の定義と違いは?
- 電池の電極の質量変化を計算してみよう【ダニエル電池の質量変化】
- 絶対質量と相対質量 相対質量の計算方法(絶対質量との変換)
- ルシャトリエの法則(原理)とは?
- 電気分解とは?塩化銅水溶液(CuCl2)における電気分解の反応式 陽極・陰極での反応式 陽極、陰極、正極、負極の違いと覚え方(見分け方)
- 水の電気分解の仕組み・反応式 陽極・陰極での反応式 水酸化ナトリウムを入れる理由は?
- ヘスの法則と熱化学方程式の関係 計算問題を解き、反応熱を求めてみよう【演習問題】
- ボルンハーバーサイクルとは?イオン結晶の格子エネルギー(格子エンタルピー)を計算してみよう
- 同位体と同素体の違いは?
- 物質量とモル質量の違いは?計算問題を解いてみよう【演習問題】
- 乾燥剤と気体の酸性・塩基性・中性とは?
- 気体の酸性度 酸性気体、中性気体、塩基性(アルカリ性)気体
- 潮解性・吸湿性・脱水性の違いは?
- 生石灰と消石灰とは?分子式(化学式)や用途の違い 生石灰と水との反応式は?
- ソーダ石灰の性質や塩基性(アルカリ性)の乾燥剤としての役割(アンモニアや二酸化炭素は吸収できる?)
- 単体、化合物、純物質、混合物の定義や違い
- 気体の水溶性と気体の収集方法(上方置換、下方置換、水上置換)
- 塩化水素が水に溶けやすい理由は?
- アンモニアが水に溶けやすい理由は?
- 「原子量・分子量・式量」とモル質量との違い
- 物質量(モル:mol)とアボガドロ数の違いや関係は? 計算問題を解いてみよう
- コロイドの性質 チンダル現象・ブラウン運動・電気泳動とは?
- クメン法とは?クメンヒドロペルオキシドを経由してフェノールを合成する方法
- 過酸化水素に二酸化マンガンを加えた時の反応式は?
- 疎水コロイド・親水コロイド・保護コロイド 凝析と塩析とは?
- 十酸化四リンの化学式、分子式(P4O10)、構造式は? 十酸化四リンと五酸化二リンの違いは?
- 乾燥剤である十酸化四リンが使用できない物質は? 潮解性や脱水作用を持つのか?
- リンの同素体 黄リンと赤リンの違いは?
- 分子結晶と共有結晶(共有結合性結晶)の違いは?
- 酸素の同素体 酸素とオゾンの違いは?
- 炭素の同素体 黒鉛(グラファイト)・ダイヤモンド・フラーレンの違いは?
- 浸透圧とファントホッフの式 計算問題を解いてみよう【演習問題】
- イオン結晶とイオン結合 イオン結晶の融点・沸点・電気伝導性などの性質
- 金属結晶と金属結合 金属結晶の融点・沸点・電気伝導性などの性質
- 自由電子と価電子の違いは?
- 共有結晶(共有結合結晶)と共有結合 共有結晶の融点・沸点・電気伝導性などの性質
- 分子結晶と分子間力 分子結晶の融点・沸点・電気伝導性などの性質
- 配位結合とは?配位結合の強さと矢印の書き方 共有結合・イオン結合・水素結合との違いは?
- 金属の配位結合と錯イオン(錯体) 中心金属、配位子、配位数とは?
- 食塩水の電気分解における電極での反応式(イオン式) 陽極で塩素が発生し、陰極で水素が発生する理由
- 二酸化マンガンと塩酸の反応式は?【半反応式から解説】