イオンとはそもそも何のこと?(その1)イオン発見の歴史と原子の構造
このページでは、イオンとはそもそも何のことか?考える上で必要な知識である
・イオンが発見される歴史(電気分解と元素、イオンの発見)
・原子の構造
・原子の構造と原子番号
について解説しています。
イオンの歴史概略(電気分解と元素、イオンの発見)
当サイトでは、メインテーマとしてリチウムイオン電池を扱っています。
それでは、そもそもこの「イオン」とは何なのか、イオンの考え方が取り入れられた背景を歴史からから解説していきます。
実は、電池や電気化学と関係が深いファラデーの法則でも有名なマイケル・ファラデーさんにより、「イオン」という言葉は命名されています(1984年)。
そして、命名されるきっかけとして、アレッサンドロ・ボルタさん1800年初頭に開発したボルタ電池も関連しています。
あるゆる化学者がこの流れに乗り、その電池反応と逆向きの反応である電気分解により物質が元素に分解できるということが徐々に明かされていったのです。
結果として、いくつかの元素、例えばカリウム(K)やカルシウム(Ca)などが発見されました背景があります。
しかし、この当時は「通電自体がどのような現象であるのか?」「電子とはいったい何なのか?」など解明されていないことが多かったようです。
その中でも、ファラデーさんはイオンの実体はわからないものの、電気分解時液体中の物質が何かに分かれれ、正極、負極の各々に向かうということを捉えていました。
(水の電気分解はこちらのページで解説しています。)
さらに、化学反応の反応速度を数式化したアレニウスの法則で有名なスバンテ・アレニウスさんにより、イオンの実体は電荷を帯びた原子もしくは原子の集まりであるという仮説が立てられ、
後に原子の構造が明らかになるに伴い、この仮説が正しいことが証明されたようです。
(この当時は原子は最小のそれ以上分割できない単位と考えられており、 その原子が電荷を帯びること自体が容易に想像できないものだったようです)。
次に、原子の構造について解説します。
関連記事
ボルタ電池の反応・特徴
ファラデーの法則とは?
水の電気分解での反応
アレニウスの法則
価電子とは?数え方や覚え方 最外殻電子との違いや周期表と価電子数との関係
原子の構造
原子の構造は下図の通りであり、下図全体が原子全体を表しており
陽子、中性子、電子から構成されます。原子の中央部分に位置するものを原子核と呼びます。原子核は陽子と中性子で作られています。
電子はイメージ図のよう、外側の軌道(黒線)を回っているように簡易的に記載しています。
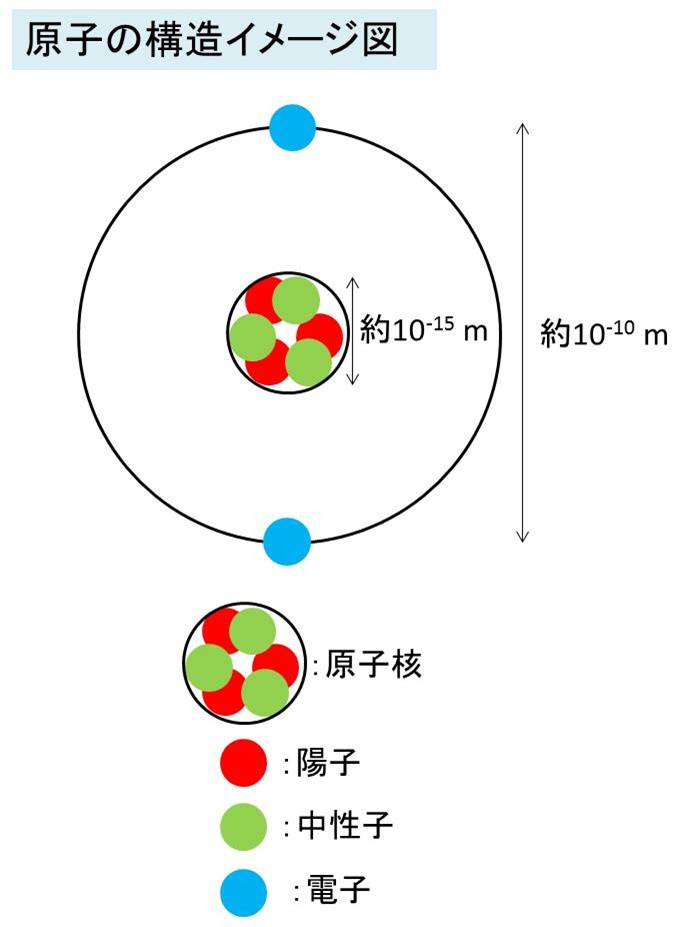
次に、原子の構造に関係する各パラメータを以下にまとめています。
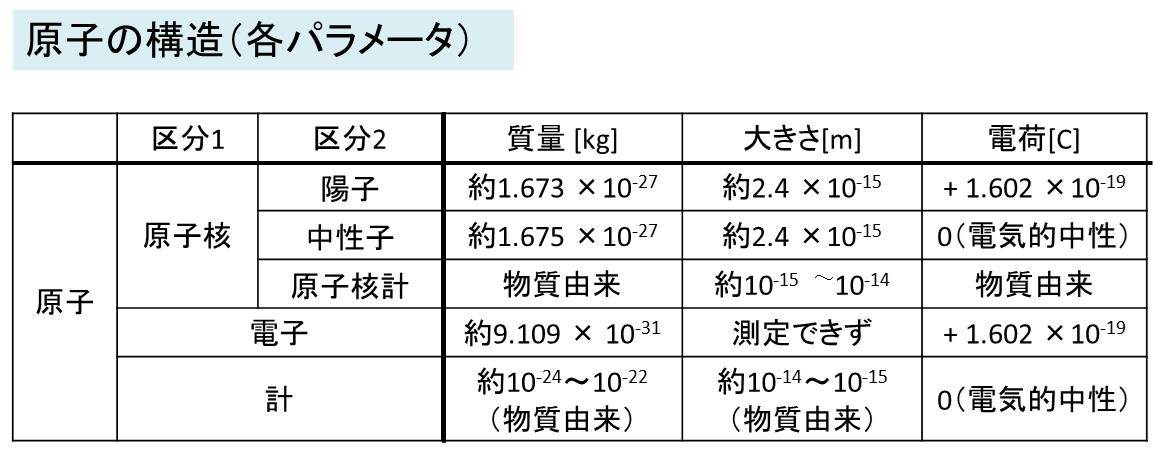
簡単にポイントを解説します。
・陽子:原子核を構成し、物質により数が異なります。 質量は中性子と同程度です。(若干軽い)。
電荷は言葉からイメージできるように陽(正、+)で1.602 × 10^19 C(クーロン)です。
また、この値を電気素量eと呼び、気素量は電気量の基礎となる物理量とされています。
・中性子:原子核を構成し、物質により数が異なります。
質量は陽子と同程度(若干重い)。 電荷は0、つまり電気的に中性のため、中性子と呼びます。
・原子核:陽子と中性子から構成され、これらの数は物質により変化します。よって、質量は物質により異なり、大きさは10^-15~10^-14 m 程度です。
・電子:ある原子において陽子の数と電子の数は同じです。質量は陽子や中性子より小さく、電荷は電気素量の符号を-にしたものです。体積は測定することが出来ていません。
詳細は下記に示す原子の構造と原子番号において解説しています。
関連記事
ボルタ電池の反応・特徴
ファラデーの法則とは?
水の電気分解での反応
アレニウスの法則
価電子とは?数え方や覚え方 最外殻電子との違いや周期表と価電子数との関係
原子の構造と原子番号、質量数
Liを例として、原子番号と質量数について解説します。
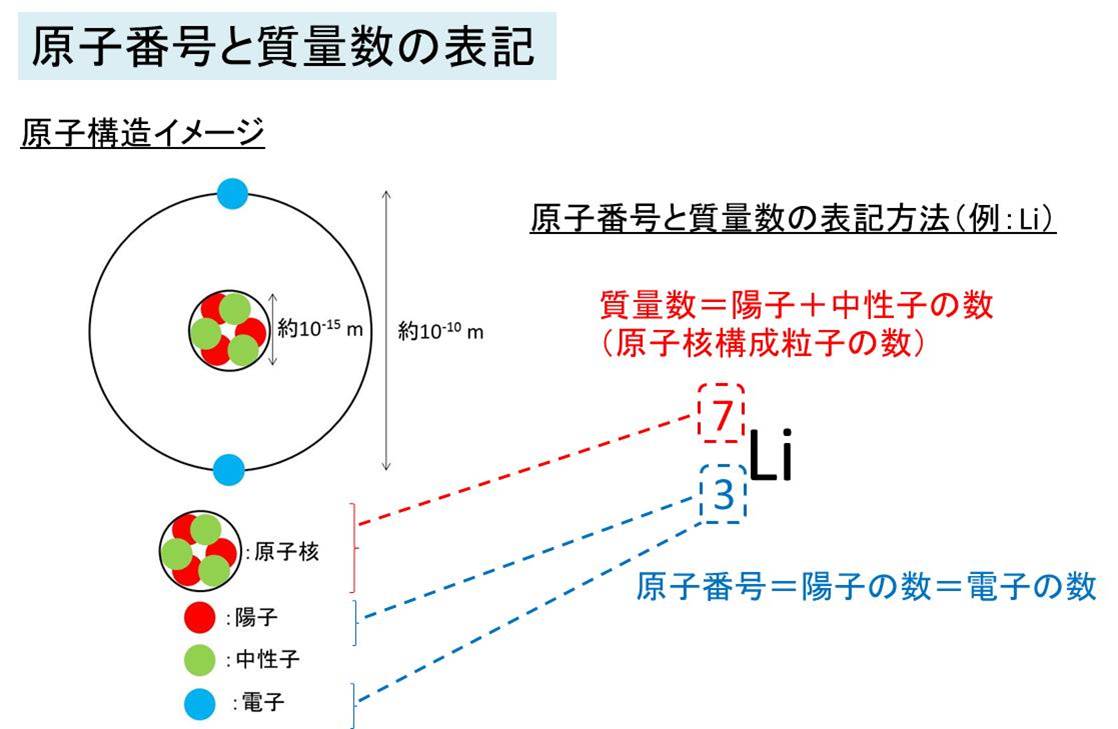
右に原子番号と質量数の表記方法について解説しました。
原子番号は元素を記載した左下に表記し、これは元素により数が決まっており、
Liでは3 となります。
この原子番号は元素の陽子の数のことでもあり、また原子において
陽子の数=電子の数であるため、電子の数も原子番号と同じです。
質量数は元素を記載した左上に表記し、こちらも元素により数が決まっており、
Liでは7 となります(6となるLiも存在し(同位体と呼びます)ますが、メインは7のリチウムです)。
この質量数は原子核を構成する粒子の数のことでもあり、陽子の数+中性子の数です。
物質ごとの原子番号等を表にしたものを周期表と呼び、縦列や横列にも関係性があり、その関係を理解しやすいものになっています
原子の構造のおおよそが理解できましたら、あとは電子配置が理解できれば、イオンの構造も理解できるようになります。
関連記事
ボルタ電池の反応・特徴
ファラデーの法則とは?
水の電気分解での反応
アレニウスの法則
価電子とは?数え方や覚え方 最外殻電子との違いや周期表と価電子数との関係
イオンとはそもそも何のこと?その1 イオン発見の歴史と原子の構造と原子番号、質量数 関連ページ
- 酸化とは?還元とは?酸化還元の定義その1、その2
- 酸化還元の定義その3とまとめ
- 電池とは?ボルタ電池の構成と反応
- ダニエル電池の構成・仕組み・反応式は?正極・負極の反応は?素焼き板の役割は?
- イオン化傾向とは?
- 【手計算・Excel】pHとは?計算方法は?
- 同位体の存在比とは?計算問題を解いてみよう【銅や塩素の質量】
- 分子量の求め方 アンモニア・メタン・尿素などの分子量を計算してみよう【演習問題】
- 原子量・分子量・式量の違いは?
- アレニウス・ブレンステッド・ルイスの酸・塩基の定義と違いは?
- 電池の電極の質量変化を計算してみよう【ダニエル電池の質量変化】
- 絶対質量と相対質量 相対質量の計算方法(絶対質量との変換)
- ルシャトリエの法則(原理)とは?
- 電気分解とは?塩化銅水溶液(CuCl2)における電気分解の反応式 陽極・陰極での反応式 陽極、陰極、正極、負極の違いと覚え方(見分け方)
- 水の電気分解の仕組み・反応式 陽極・陰極での反応式 水酸化ナトリウムを入れる理由は?
- ヘスの法則と熱化学方程式の関係 計算問題を解き、反応熱を求めてみよう【演習問題】
- ボルンハーバーサイクルとは?イオン結晶の格子エネルギー(格子エンタルピー)を計算してみよう
- 同位体と同素体の違いは?
- 物質量とモル質量の違いは?計算問題を解いてみよう【演習問題】
- 乾燥剤と気体の酸性・塩基性・中性とは?
- 気体の酸性度 酸性気体、中性気体、塩基性(アルカリ性)気体
- 潮解性・吸湿性・脱水性の違いは?
- 生石灰と消石灰とは?分子式(化学式)や用途の違い 生石灰と水との反応式は?
- ソーダ石灰の性質や塩基性(アルカリ性)の乾燥剤としての役割(アンモニアや二酸化炭素は吸収できる?)
- 単体、化合物、純物質、混合物の定義や違い
- 気体の水溶性と気体の収集方法(上方置換、下方置換、水上置換)
- 塩化水素が水に溶けやすい理由は?
- アンモニアが水に溶けやすい理由は?
- 「原子量・分子量・式量」とモル質量との違い
- 物質量(モル:mol)とアボガドロ数の違いや関係は? 計算問題を解いてみよう
- コロイドの性質 チンダル現象・ブラウン運動・電気泳動とは?
- クメン法とは?クメンヒドロペルオキシドを経由してフェノールを合成する方法
- 過酸化水素に二酸化マンガンを加えた時の反応式は?
- 疎水コロイド・親水コロイド・保護コロイド 凝析と塩析とは?
- 十酸化四リンの化学式、分子式(P4O10)、構造式は? 十酸化四リンと五酸化二リンの違いは?
- 乾燥剤である十酸化四リンが使用できない物質は? 潮解性や脱水作用を持つのか?
- リンの同素体 黄リンと赤リンの違いは?
- 分子結晶と共有結晶(共有結合性結晶)の違いは?
- 酸素の同素体 酸素とオゾンの違いは?
- 炭素の同素体 黒鉛(グラファイト)・ダイヤモンド・フラーレンの違いは?
- 浸透圧とファントホッフの式 計算問題を解いてみよう【演習問題】
- イオン結晶とイオン結合 イオン結晶の融点・沸点・電気伝導性などの性質
- 金属結晶と金属結合 金属結晶の融点・沸点・電気伝導性などの性質
- 自由電子と価電子の違いは?
- 共有結晶(共有結合結晶)と共有結合 共有結晶の融点・沸点・電気伝導性などの性質
- 分子結晶と分子間力 分子結晶の融点・沸点・電気伝導性などの性質
- 配位結合とは?配位結合の強さと矢印の書き方 共有結合・イオン結合・水素結合との違いは?
- 金属の配位結合と錯イオン(錯体) 中心金属、配位子、配位数とは?
- 食塩水の電気分解における電極での反応式(イオン式) 陽極で塩素が発生し、陰極で水素が発生する理由
- 二酸化マンガンと塩酸の反応式は?【半反応式から解説】