電池の電極の質量変化を計算してみよう【ダニエル電池の質量変化】
いま身近にある電池といえば「マンガン乾電池」「アルカリ乾電池」「リチウムイオン電池」などを思いつくでしょう。
このようないま非常に高性能な電池が開発されている背景には、もちろん電池の開発の歴史があります。
電池の歴史の中でも初期の方に発明され、いまの電池の構造の大元となっているものにダニエル電池があります。
ここでは、ダニエル電池では自身の電極が反応する(溶ける)活性電極が使用されています。つまり、電極は反応します。このときの電極の質量変化の考え方について知っていますか。
ここでは、ダニエル電池を例に用いて、電池の質量変化に関する以下の内容について解説していきます。
・ダニエル電池の質量変化と電子の関係の計算問題を解いてみよう【演習問題】
・ダニエル電池の質量変化との通電電流・時間の関係の計算問題を解いてみよう【演習問題】
というテーマで解説していきます。
ダニエル電池の質量変化と電子の関係の計算問題を解いてみよう【演習問題】
ダニエル電池の構成と動作原理を以下で簡単に説明します。
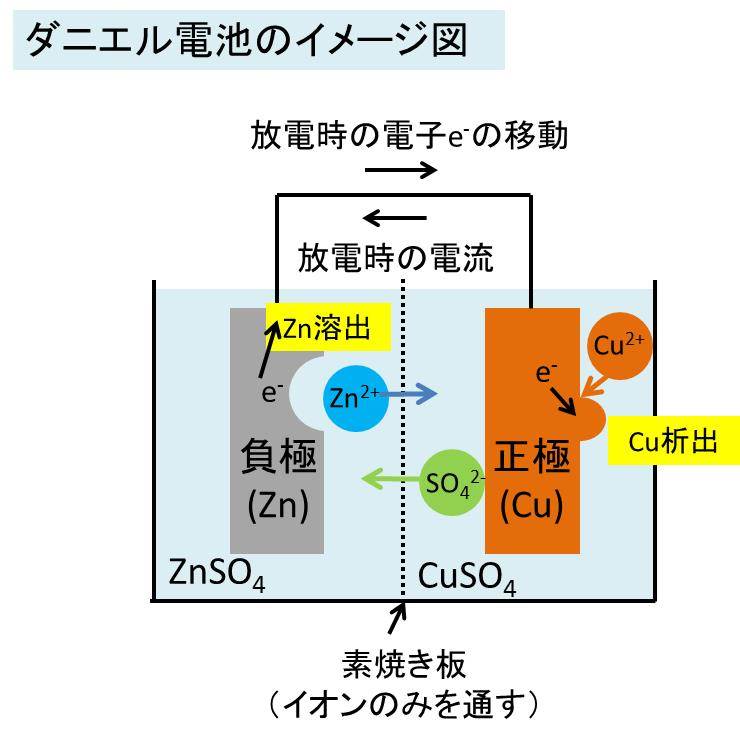
ここで、ダニエル電池の通電時(放電時)には、負極に使用されている亜鉛版がとけ、一方で正極の銅板に溶液中の銅イオンが変化し銅となったものが析出します。
つまり、負極では質量の減少変化が、正極では質量の増加変化が起こるのです。
反応式は以下の通りです。

このような、電池の質量変化(重量変化)のメカニズム(原理)がわかったところで、実際に以下の問題をといていきましょう。
例題
ダニエル電池に電子5mol分に相当する電流を通電するとします。このときの、正極と負極の重さの増減を計算してみましょう。
解答
このように、電子の物質量が与えられている問題であれば、物質量の量的関係に着目して解いていきます。
つまり、電子2molに対して、亜鉛も銅も1mol分の質量反応するのです。
ここで、亜鉛はイオンになるため溶けだし、逆に銅はイオンから金属になるため付着します。
各々の式量は亜鉛64.4、銅63.5です。
よって、正極では64.4 × 5×1/2 =161g増え、同様に負極では63.5× 5×1/2 =158.75g減るのです。
(銅の式量63.5は同位体の存在比を考慮している値です。)
(どちらの電極が溶けやすいかはイオン化傾向によって判定できます(厳密には標準電極電位))
関連記事
同位体の存在比の計算方法
イオン化傾向とは
標準電極電位とは?
電池の歴史
ダニエル電池とは?
活性電極とは?
ダニエル電池の質量変化との通電電流・時間の関係の計算問題を解いてみよう【演習問題】
上の問題では、単純に電子が移動するモル数(mol数)が計算されていました。ただ、実際は電流値(アンペア数)と通電時間から、電子の物質量を計算するのが基本です。
このとき、ファラデーの法則を使用すればいいのです。
例題
3Aを10分間流した際のダニエル電池における重さの変化量を計算してみましょう。
解答
まずは流れた電気量を計算します。
C=A・sの関係を利用すると 3 × 10 × 60 = 1800Cとなります。
ここでファラデー定数96500C/molより、流れた電流に対応する電子のmol数を考えると1800/96500より0.01865molとなります。
後は先にも述べた計算式と先にも述べたものと同様です。
正極では64.4 × 0.01865 ×1/2 =0.60g増え、同様に負極では63.5× 0.01865 ×1/2 =0.59g減るのです
これはめっきの質量変化であったり、リチウムイオン電池におけるリチウム金属が析出した際の計算に利用されます。
関連記事
同位体の存在比の計算方法
イオン化傾向とは
標準電極電位とは?
電池の歴史
ダニエル電池とは?
活性電極とは?
ファラデーの法則
電池の電極の質量変化を計算してみよう【ダニエル電池の質量変化】 関連ページ
- イオンとはそもそも何のこと?その1 イオン発見の歴史と原子の構造と原子番号、質量数
- 酸化とは?還元とは?酸化還元の定義その1、その2
- 酸化還元の定義その3とまとめ
- 電池とは?ボルタ電池の構成と反応
- ダニエル電池の構成・仕組み・反応式は?正極・負極の反応は?素焼き板の役割は?
- イオン化傾向とは?
- 【手計算・Excel】pHとは?計算方法は?
- 同位体の存在比とは?計算問題を解いてみよう【銅や塩素の質量】
- 分子量の求め方 アンモニア・メタン・尿素などの分子量を計算してみよう【演習問題】
- 原子量・分子量・式量の違いは?
- アレニウス・ブレンステッド・ルイスの酸・塩基の定義と違いは?
- 絶対質量と相対質量 相対質量の計算方法(絶対質量との変換)
- ルシャトリエの法則(原理)とは?
- 電気分解とは?塩化銅水溶液(CuCl2)における電気分解の反応式 陽極・陰極での反応式 陽極、陰極、正極、負極の違いと覚え方(見分け方)
- 水の電気分解の仕組み・反応式 陽極・陰極での反応式 水酸化ナトリウムを入れる理由は?
- ヘスの法則と熱化学方程式の関係 計算問題を解き、反応熱を求めてみよう【演習問題】
- ボルンハーバーサイクルとは?イオン結晶の格子エネルギー(格子エンタルピー)を計算してみよう
- 同位体と同素体の違いは?
- 物質量とモル質量の違いは?計算問題を解いてみよう【演習問題】
- 乾燥剤と気体の酸性・塩基性・中性とは?
- 気体の酸性度 酸性気体、中性気体、塩基性(アルカリ性)気体
- 潮解性・吸湿性・脱水性の違いは?
- 生石灰と消石灰とは?分子式(化学式)や用途の違い 生石灰と水との反応式は?
- ソーダ石灰の性質や塩基性(アルカリ性)の乾燥剤としての役割(アンモニアや二酸化炭素は吸収できる?)
- 単体、化合物、純物質、混合物の定義や違い
- 気体の水溶性と気体の収集方法(上方置換、下方置換、水上置換)
- 塩化水素が水に溶けやすい理由は?
- アンモニアが水に溶けやすい理由は?
- 「原子量・分子量・式量」とモル質量との違い
- 物質量(モル:mol)とアボガドロ数の違いや関係は? 計算問題を解いてみよう
- コロイドの性質 チンダル現象・ブラウン運動・電気泳動とは?
- クメン法とは?クメンヒドロペルオキシドを経由してフェノールを合成する方法
- 過酸化水素に二酸化マンガンを加えた時の反応式は?
- 疎水コロイド・親水コロイド・保護コロイド 凝析と塩析とは?
- 十酸化四リンの化学式、分子式(P4O10)、構造式は? 十酸化四リンと五酸化二リンの違いは?
- 乾燥剤である十酸化四リンが使用できない物質は? 潮解性や脱水作用を持つのか?
- リンの同素体 黄リンと赤リンの違いは?
- 分子結晶と共有結晶(共有結合性結晶)の違いは?
- 酸素の同素体 酸素とオゾンの違いは?
- 炭素の同素体 黒鉛(グラファイト)・ダイヤモンド・フラーレンの違いは?
- 浸透圧とファントホッフの式 計算問題を解いてみよう【演習問題】
- イオン結晶とイオン結合 イオン結晶の融点・沸点・電気伝導性などの性質
- 金属結晶と金属結合 金属結晶の融点・沸点・電気伝導性などの性質
- 自由電子と価電子の違いは?
- 共有結晶(共有結合結晶)と共有結合 共有結晶の融点・沸点・電気伝導性などの性質
- 分子結晶と分子間力 分子結晶の融点・沸点・電気伝導性などの性質
- 配位結合とは?配位結合の強さと矢印の書き方 共有結合・イオン結合・水素結合との違いは?
- 金属の配位結合と錯イオン(錯体) 中心金属、配位子、配位数とは?
- 食塩水の電気分解における電極での反応式(イオン式) 陽極で塩素が発生し、陰極で水素が発生する理由
- 二酸化マンガンと塩酸の反応式は?【半反応式から解説】