物質量(モル:mol)とアボガドロ数の違いや関係は? 計算問題を解いてみよう
高校化学において重要な考え方に「物質量(単位モル:mol)」や「アボガドロ数(アボガドロ定数)」などの用語があります。
ここでは、このモル(物質量)とアボガドロ数の違いや関係について解説していきます。
・物質量(モル:mol))とアボガドロ数の違いや関係
・物質量(モル:mol)とアボガドロ数の違いや関係は?モルと粒子数の計算問題を解いてみよう【演習問題】
というテーマで解説していきます。
物質量(モル:mol))とアボガドロ数の違いや関係
化学における基礎用語に物質量(単位;モル)があり、これをきちんと理解していないと化学が全般的にわからなくなってしまいます。そのため、きちんと学習しておきましょう。
物質量の単位はモル(mol)で表記することが基本です。そして、このモルと関係する用語にアボガドロ数と呼ばれるものがあります。それでは、物質量(モル)とアボガドロ数にはどのような関係があるのでしょうか。
実は、物質量1mol(モル)には、物質の原子の個数がアボガドロ数(6.02 × 10^23個)分含まれます。
原子量・分子量・式量の基準物質C12(質量数12)において、炭素原子がアボガドロ数(6.02 × 10^23個)個分集まったものが12gとなります。このアボガドロ数分の粒子数の集まりのことを1molと定義しているのです。
以下のようなイメージです。
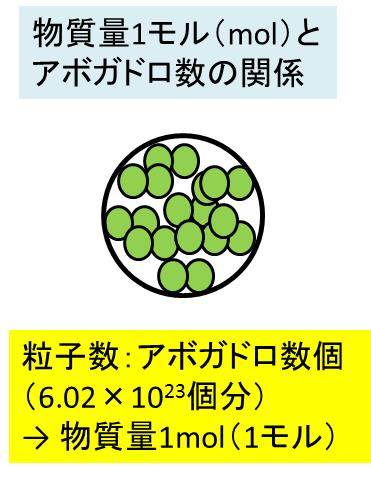
このアボガドロ数と物質量(モル数)との関係は、みかんを箱に仕分けることに似ています。
例えば、総数100個のみかんがあり、それを5個ずつ箱に分けるとしましょう。すると、100/5=20箱分が必要となります。
ここで、分ける個数の単位5個がアボガドロ数にあたり、箱の数がモル数の相当するのです。
そして、1molあたりの質量をモル質量と呼びます(値は原子量や分子量・式量と同じですが、単位は異なります)。
炭素1mol(モル)では先にも述べたように、12g/molとなります。他にも水分子(H2O)であったら、18g/molとなちます。
これらが、モル(物質量)とアボガドロ定数の関係です。きちんと理解しておきましょう。
関連記事
原子量や分子量・式量とモル質量との関係
相対質量と絶対質量の違い
物質量とモル質量の違いは?
物質量(モル)と粒子数の計算問題を解いてみよう【演習問題】
このように、1molはアボガドロ数分(6.02×10^23個分)の粒子(原子)の集まりといえます。
この変換方法になれるためにも、実際にモル数(物質量)と粒子数に関する計算問題を解いてみましょう。
例題1
酸素分子2molには、分子の数は何個含まれるでしょうか、
解答1
酸素分子として2molあるために、単純に2 × 6.02 × 10^23 =1.24 × 10^24 個分の分子が含まれます。
※※
例題2
酸素分子3molには、酸素原子の数は何個含まれるでしょうか、
解答2
酸素分子としては、3× 6.02 × 10^23 個が存在します。さらに、酸素分子あ酸素原子2個分で構成されるために、酸素原子の粒子数は分子数の2倍です。
よって、2 × 3 × 6.02 × 10^23 = 3.61 × 10^24個分の酸素原子が含まれるといえます
※※
例題3
酸素分子3.01 × 10^23個は、酸素分子の物質量何mol(モル)に相当するのでしょうか。
解答3
個数をアボガドロ数で割っていきます。3.01 × 10^23 / (6.02 × 10^23) = 0.5molとなります。
例題4
酸素分子3.01 × 10^23個の中に、酸素原子は物質量何mol分含まれているでしょうか。
解答4
酸素原子は酸素分子の中に2個含有しているために、2×3.01 × 10^23 / (6.02 × 10^23) = 1molとなります。
例題5
メタン分子(CH4)6.02 × 10^23個の中に、水素原子は物質量何mol含まれているでしょうか。
解答5
水素原子はメタン分子の中に4個含有しているので、4×6.02× 10^23 / (6.02 × 10^23) = 4molとなります。
一つ一つ丁寧に用語を確認していきましょう。
関連記事
原子量や分子量・式量とモル質量との関係
相対質量と絶対質量の違い
物質量とモル質量の違いは?
物質量(モル:mol)とアボガドロ数の違いや関係は? 計算問題を解いてみよう 関連ページ
- イオンとはそもそも何のこと?その1 イオン発見の歴史と原子の構造と原子番号、質量数
- 酸化とは?還元とは?酸化還元の定義その1、その2
- 酸化還元の定義その3とまとめ
- 電池とは?ボルタ電池の構成と反応
- ダニエル電池の構成・仕組み・反応式は?正極・負極の反応は?素焼き板の役割は?
- イオン化傾向とは?
- 【手計算・Excel】pHとは?計算方法は?
- 同位体の存在比とは?計算問題を解いてみよう【銅や塩素の質量】
- 分子量の求め方 アンモニア・メタン・尿素などの分子量を計算してみよう【演習問題】
- 原子量・分子量・式量の違いは?
- アレニウス・ブレンステッド・ルイスの酸・塩基の定義と違いは?
- 電池の電極の質量変化を計算してみよう【ダニエル電池の質量変化】
- 絶対質量と相対質量 相対質量の計算方法(絶対質量との変換)
- ルシャトリエの法則(原理)とは?
- 電気分解とは?塩化銅水溶液(CuCl2)における電気分解の反応式 陽極・陰極での反応式 陽極、陰極、正極、負極の違いと覚え方(見分け方)
- 水の電気分解の仕組み・反応式 陽極・陰極での反応式 水酸化ナトリウムを入れる理由は?
- ヘスの法則と熱化学方程式の関係 計算問題を解き、反応熱を求めてみよう【演習問題】
- ボルンハーバーサイクルとは?イオン結晶の格子エネルギー(格子エンタルピー)を計算してみよう
- 同位体と同素体の違いは?
- 物質量とモル質量の違いは?計算問題を解いてみよう【演習問題】
- 乾燥剤と気体の酸性・塩基性・中性とは?
- 気体の酸性度 酸性気体、中性気体、塩基性(アルカリ性)気体
- 潮解性・吸湿性・脱水性の違いは?
- 生石灰と消石灰とは?分子式(化学式)や用途の違い 生石灰と水との反応式は?
- ソーダ石灰の性質や塩基性(アルカリ性)の乾燥剤としての役割(アンモニアや二酸化炭素は吸収できる?)
- 単体、化合物、純物質、混合物の定義や違い
- 気体の水溶性と気体の収集方法(上方置換、下方置換、水上置換)
- 塩化水素が水に溶けやすい理由は?
- アンモニアが水に溶けやすい理由は?
- 「原子量・分子量・式量」とモル質量との違い
- コロイドの性質 チンダル現象・ブラウン運動・電気泳動とは?
- クメン法とは?クメンヒドロペルオキシドを経由してフェノールを合成する方法
- 過酸化水素に二酸化マンガンを加えた時の反応式は?
- 疎水コロイド・親水コロイド・保護コロイド 凝析と塩析とは?
- 十酸化四リンの化学式、分子式(P4O10)、構造式は? 十酸化四リンと五酸化二リンの違いは?
- 乾燥剤である十酸化四リンが使用できない物質は? 潮解性や脱水作用を持つのか?
- リンの同素体 黄リンと赤リンの違いは?
- 分子結晶と共有結晶(共有結合性結晶)の違いは?
- 酸素の同素体 酸素とオゾンの違いは?
- 炭素の同素体 黒鉛(グラファイト)・ダイヤモンド・フラーレンの違いは?
- 浸透圧とファントホッフの式 計算問題を解いてみよう【演習問題】
- イオン結晶とイオン結合 イオン結晶の融点・沸点・電気伝導性などの性質
- 金属結晶と金属結合 金属結晶の融点・沸点・電気伝導性などの性質
- 自由電子と価電子の違いは?
- 共有結晶(共有結合結晶)と共有結合 共有結晶の融点・沸点・電気伝導性などの性質
- 分子結晶と分子間力 分子結晶の融点・沸点・電気伝導性などの性質
- 配位結合とは?配位結合の強さと矢印の書き方 共有結合・イオン結合・水素結合との違いは?
- 金属の配位結合と錯イオン(錯体) 中心金属、配位子、配位数とは?
- 食塩水の電気分解における電極での反応式(イオン式) 陽極で塩素が発生し、陰極で水素が発生する理由
- 二酸化マンガンと塩酸の反応式は?【半反応式から解説】